Молекула льда своими руками
Добавил пользователь Владимир З. Обновлено: 08.09.2024
Из 14 известных на сегодняшний день форм твердой воды в природе мы встречаем только одну ? лед. Остальные образуются в экстремальных условиях и для наблюдений вне специальных лабораторий недоступны. Самое интригующее свойство льда ? это удивительное многообразие внешних проявлений. При одной и той же кристаллической структуре он может выглядеть совершенно по-разному, принимая форму прозрачных градин и сосулек, хлопьев пушистого снега, плотной блестящей корки фирна на снежном поле или же гигантских ледниковых масс.
Молекулы в ажуре
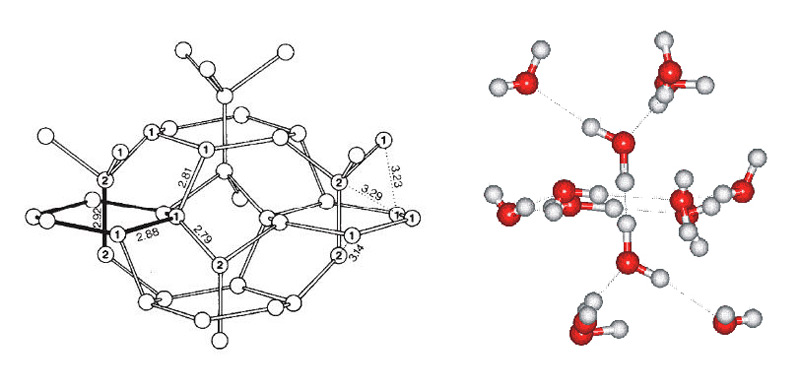
Разгадка структуры твердой воды кроется в строении ее молекулы. Н2О можно упрощенно представить себе в виде тетраэдра (пирамиды с треугольным основанием). В центре находится кислород, в двух вершинах ? по водороду, точнее ? протону, электроны которых задействованы в образовании ковалентной связи с кислородом. Две оставшиеся вершины занимают пары валентных электронов кислорода, которые не участвуют в образовании внутримолекулярных связей, отчего их называют неподеленными.
Кристаллическая структура льда: молекулы воды соединены в правильные шестиугольники
При взаимодействии протона одной молекулы с парой неподеленных электронов кислорода другой молекулы возникает водородная связь, менее сильная, чем связь внутримолекулярная, но достаточно могущественная, чтобы удерживать рядом соседние молекулы. Каждая молекула может одновременно образовывать четыре водородные связи с другими молекулами под строго определенными углами, которые не позволяют при замерзании создавать плотную структуру. Этот невидимый каркас из водородных связей располагает молекулы в виде ажурной сетки с полыми каналами. Стоит лед нагреть, как кружево рушится: молекулы воды начинают проваливаться в пустоты сетки, приводя к более плотной структуре жидкости, ? вот почему вода тяжелее льда.
Лед, который образуется при атмосферном давлении и плавится при 0°С, ? самое привычное, но все еще не до конца понятное вещество. Многое в его структуре и свойствах выглядит необычно. В узлах кристаллической решетки льда атомы кислорода выстроены упорядоченно, образуя правильные шестиугольники, а вот атомы водорода занимают самые разные положения вдоль связей. Такое поведение атомов вообще-то нетипично ? как правило, в твердом веществе все подчиняются одному закону: либо все атомы расположены упорядоченно, и тогда это ? кристалл, либо случайно, и тогда это ? аморфное вещество.
Градины ? кусочки льда, образующиеся в дождевых тучах, если капли воды остаются жидкими при температуре ниже нуля
Лед трудно расплавить, как бы ни странно это звучало. Не будь водородных связей, сцепляющих молекулы воды, он плавился бы при ?90°С. При этом, замерзая, вода не уменьшается в объеме, как это происходит с большинством известных веществ, а увеличивается ? за счет образования ажурной структуры льда.
Неправильный лед
В твердом состоянии вода насчитывает, по последним данным, 14 структурных модификаций. Есть среди них кристаллические (их большинство), есть аморфные, но все они отличаются друг от друга взаимным расположением молекул воды и свойствами. Правда, все, кроме привычного нам льда, образуются в условиях экзотических ? при очень низких температурах и высоких давлениях, когда углы водородных связей в молекуле воды изменяются и образуются системы, отличные от гексагональной. Например, при температуре ниже ?110°С водяные пары выпадают на металлической пластине в виде октаэдров и кубиков размером в несколько нанометров ? это так называемый кубический лед. Если температура чуть выше ?110°, а концентрация пара очень мала, на пластине формируется слой исключительно плотного аморфного льда.
Две последние модификации льда ? XIII и XIV ? открыли ученые из Оксфорда совсем недавно, в 2006 году. Предсказание 40-летней давности о том, что должны существовать кристаллы льда с моноклинной и ромбической решетками, было трудно подтвердить: вязкость воды при температуре ?160°С очень велика, и собраться вместе молекулам сверхчистой переохлажденной воды в таком количестве, чтобы образовался зародыш кристалла, трудно. Помог катализатор ? соляная кислота, которая повысила подвижность молекул воды при низких температурах. В земной природе подобные модификации льда образовываться не могут, но их можно поискать на замерзших спутниках других планет.
Комиссия решила так
Форма снежинок зависит от погодных условий во время их образования, поэтому они никогда не бывают одинаковыми
Самые знаменитые последователи дела Бентли ? это уже упомянутый Укихиро Накайя и американский физик Кеннет Либбрехт . Накайя впервые предположил, что величина и форма снежинок зависят от температуры воздуха и содержания в нем влаги, и блистательно подтвердил эту гипотезу экспериментально, выращивая в лаборатории кристаллы льда разной формы. А Либбрехт у себя в Калифорнийском технологическом институте и вовсе стал выращивать снежинки на заказ ? заранее заданной формы.
Жизнь снежинки начинается с того, что в облаке водяного пара при понижении температуры образуются кристаллические зародыши льда. Центром кристаллизации могут быть пылинки, любые твердые частицы или даже ионы, но в любом случае эти льдинки размером меньше десятой доли миллиметра уже имеют гексагональную кристаллическую решетку.
Водяной пар, конденсируясь на поверхности этих зародышей, образует сначала крошечную гексагональную призму, из шести углов которой начинают расти совершенно одинаковые ледяные иголочки ? боковые отростки. Одинаковые просто потому, что температура и влажность вокруг зародыша тоже одинаковые. На них в свою очередь вырастают, как на дереве, боковые отростки ? веточки. Подобные кристаллы так и называют дендритами, то есть похожими на дерево.
Морозные рисунки на стекле ? это большие кристаллы льда, растущие из водяного пара на границе тепла и холода
Чтобы не путаться с многообразием снежинок, Международная комиссия по снегу и льду приняла в 1951 году довольно простую классификацию кристаллов льда: пластинки, звездчатые кристаллы, столбцы или колонны, иглы, пространственные дендриты, столбцы с наконечниками и неправильные формы. И еще три вида обледенелых осадков: мелкая снежная крупка, ледяная крупка и град.
Тем же законам подчиняется и рост инея, изморози и узоров на стеклах. Эти явления, как и снежинки, образуются при конденсации, молекула за молекулой ? на земле, траве, деревьях. Узоры на окне появляются в мороз, когда на поверхности стекла конденсируется влага теплого комнатного воздуха. А вот градины получаются при застывании капель воды или когда в насыщенных водяным паром облаках лед плотными слоями намерзает на зародыши снежинок. На градины могут намерзать другие, уже сформировавшиеся снежинки, сплавляясь с ними, благодаря чему градины принимают самые причудливые формы.
Нам на Земле довольно и одной твердой модификации воды ? обычного льда. Он буквально пронизывает все области обитания или пребывания человека. Собираясь в огромных количествах, снег и лед образуют особые структуры с принципиально иными, нежели у отдельных кристаллов или снежинок, свойствами. Горные ледники , ледяные покровы акваторий, вечная мерзлота, да и просто сезонный снежный покров существенно влияют на климат больших регионов и планеты в целом: даже те, кто никогда не видел снега, чувствуют на себе дыхание его масс, скопившихся на полюсах Земли, например, в виде многолетних колебаний уровня Мирового океана. А лед имеет столь большое значение для облика нашей планеты и комфортного обитания на ней живых существ, что ученые отвели для него особую среду ? криосферу, которая простирает свои владения высоко в атмосферу и глубоко в земную кору.
В создании этой статьи участвовала наша опытная команда редакторов и исследователей, которые проверили ее на точность и полноту.
Команда контент-менеджеров wikiHow тщательно следит за работой редакторов, чтобы гарантировать соответствие каждой статьи нашим высоким стандартам качества.
Может ли лед был горячим? Да, если это не обычный лед. Ацетат натрия получается из тех же ингредиентов, которые используются для создания вулкана из пищевой соды. При охлаждении ацетата натрия ниже температуры замерзания образуется жидкость, готовая затвердеть при малейшем толчке. В процессе лавинообразной кристаллизации выделяется тепло, и получается "горячий лед".


- Не используйте порошок для выпечки, поскольку в нем содержатся другие вещества, способные повлиять на процесс.

- Таким образом, вы используете 5-процентную уксусную кислоту (обычная концентрация стандартного уксуса). В данном случае в точных измерениях нет надобности.

Подождите, пока жидкость прекратит шипеть. В результате реакции уксуса (уксусной кислоты) и пищевой соды (двууглекислого натрия) образуется ацетат натрия и выделяется углекислый газ, что и приводит к шипению. Пока жидкость продолжает шипеть, хорошо перемешайте ее, чтобы растворилась вся сода, и подождите, пока закончится реакция.

Убедитесь в том, что прореагировала вся сода. Если в кастрюле остались крупинки соды, добавляйте уксус до тех пор, пока они не исчезнут. В противном случае вам не удастся переохладить жидкость до намеченной температуры, так как оставшаяся сода вызовет преждевременную кристаллизацию.

- Если жидкость помутнела и приобрела коричневый цвет, добавьте немного уксуса и прокипятите ее еще раз.
- В начале ацетат натрия образуется в виде "тригидрата ацетата натрия", в состав которого входит вода. В процессе выпаривания молекулы воды испаряются, и в результате образуется "безводный ацетат натрия".

Соскребите кристаллы со стенок кастрюли. По мере испарения воды уровень жидкости будет понижаться, и вы заметите, что на стенках кастрюли осели кристаллы ацетата натрия. Возьмите ложку и соберите их в отдельную емкость — они понадобятся вам позже. Это можно проделать в любое время, пока жидкость продолжает кипеть.
- Рекомендуется добавить 1-2 столовые ложки (15–30 мл) уксуса. Уксус поможет удержать раствор в жидком состоянии и предотвратит образование поверхностной пленки.

- Если на данном этапе жидкость кристаллизуется, вероятно, в ней остались кристаллические частицы или другие примеси. Добавьте немного уксуса, вновь поставьте раствор на плиту, расплавьте его и повторите процедуру. Это непростой процесс, и он редко получается с первого же раза.

Добавьте в жидкость немного кристаллического ацетата натрия. Используйте порошок, который вы собрали ранее со стенок кастрюли при выпаривании раствора. Для начала добавьте 1-2 щепотки; если ничего не произошло, подсыпьте еще немного.
Мы все с вами привыкли видеть лед, держать его в руках, помним ощущения от прикосновения к холодной поверхности, знакомы с поведением льда, наблюдаем за процессом таяния и любуемся его прозрачностью. Но бывает ли другой лед, отличающийся от того, который мы знаем? Да, конечно бывает. Но давая более полный ответ на этот вопрос, нам следует его уточнить, так как существует несколько категорий, по которым мы можем различать тот или иной вид льда.
Во-первых, лед на Земле имеет различную природу происхождения – материковый лед, подземный, морской, атмосферный и т.д. А если говорить о разновидностях льда вне нашей планеты, то они серьезно отличаются от привычного нам, вследствие экстремальных условий в которых они образуются (читайте об этом в нашем разделе Космический лед ).
В-третьих, различают кристаллические решетки (модификации) водяного льда, образование которых обусловлено термодинамическим фактором. Вот о них-то мы и поговорим немного в этой заметке.

Илл. 1. Кристаллическая решетка водяного льда. Выделена базовая часть решетки – тетраэдр.
В статье Лед мы с вами остановились на том, как происходит перестройка структуры воды с изменением ее агрегатных состояний, и затронули кристаллическое строение обыкновенного льда. Благодаря внутреннему устройству самой молекулы воды и водородным связям, соединяющим все молекулы в упорядоченную систему, образуется гексагональная (шестиугольная) кристаллическая решетка льда. Ближайшие друг к другу молекулы (одна центральная и четыре угловых) расположены в форме трехгранной пирамиды, или тетраэдра, который лежит в основе гексагональной кристаллической модификации (илл.1).
Кстати, расстояние между мельчайшими частицами вещества измеряются в нанометрах (нм) или ангстремах (по имени шведского физика XIX века Андерса Йонаса Ангстрема; обозначается символом ?). 1 ? = 0,1 нм = 10-10 м.

Илл. 2. Шестиугольное строение ледяных кристаллов.
Такое шестиугольное строение обыкновенного льда распространяется на весь его объем. Наглядно в этом можно убедиться невооруженным глазом: зимой во время снегопада поймайте снежинку на рукав одежды или на перчатку и приглядитесь к ее форме – она шестилучевая или шестиугольная. Это характерно для каждой снежинки, но при этом ни одна снежинка никогда не повторяет другую (подробнее об этом в нашей статье Снежинки – микроледяные скульптуры ). И даже крупные кристаллы льда своей внешней формой отвечают внутреннему молекулярному строению (илл.2).
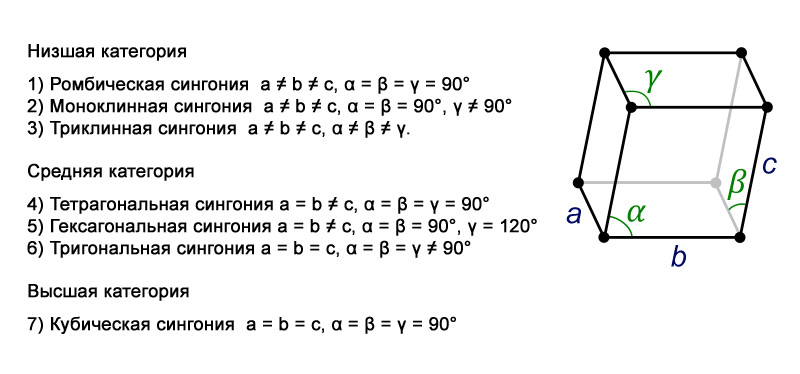
Илл. 3. Виды сингоний
Мы уже говорили, что переход вещества, в частности воды, из одного состояния в другое осуществляется при наличии определенных условий. Привычный лед образуется при температуре от 0°C и ниже и при давлении в 1 атмосферу (нормальное значение). Следовательно, для появления иных модификаций льда требуется изменение этих значений, и в большинстве случаев наличие низких температур и высокого давления, при которых происходит изменение угла водородных связей и реконструкция всей кристаллической решетки.
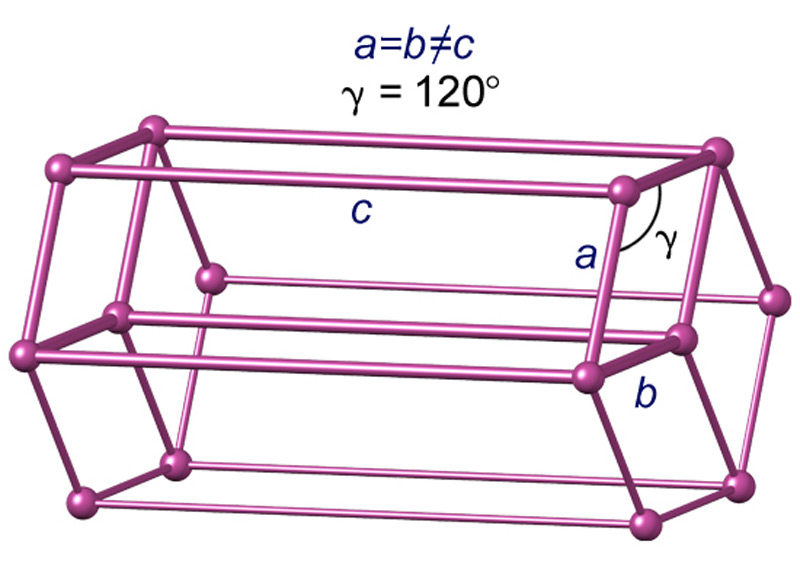
Илл. 4. Гексагональная сингония.
Каждая модификация льда относится к определенной сингонии – группе кристаллов, в которых элементарные ячейки обладают одной и той же симметрией и системой координат (оси XYZ). Всего же различают семь сингоний. Характеристики каждой из них представлены на иллюстрациях 3-4. А чуть ниже дано изображение основных форм кристаллов (илл.5)
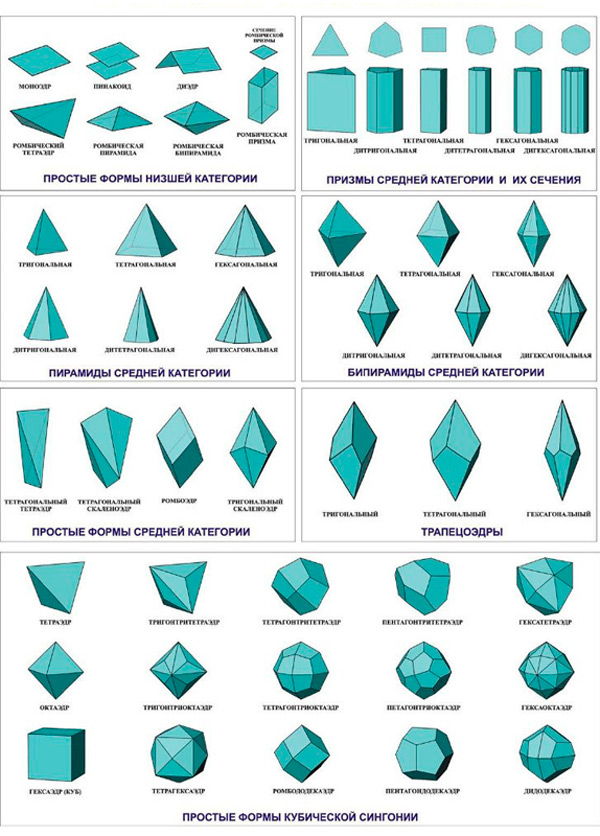
Илл. 5. Формы кристаллов.
Все модификации льда, отличающиеся от обыкновенного, были получены в лабораторных условиях. О первых полиморфных структурах льда стало известно в начале XX века стараниями ученых Густава Таммана (Gustav Heinrich Tammann) и Перси Бриджмена (Percy Williams Bridgman). Диаграмма модификаций, составленная Бриджменом, периодически дополнялась. Новые модификации выявляли из полученных ранее. Последние изменения в диаграмму были внесены уже в наше время. На данный момент получено шестнадцать кристаллических типов льда. Каждый тип имеет свое наименование и обозначается римской цифрой.
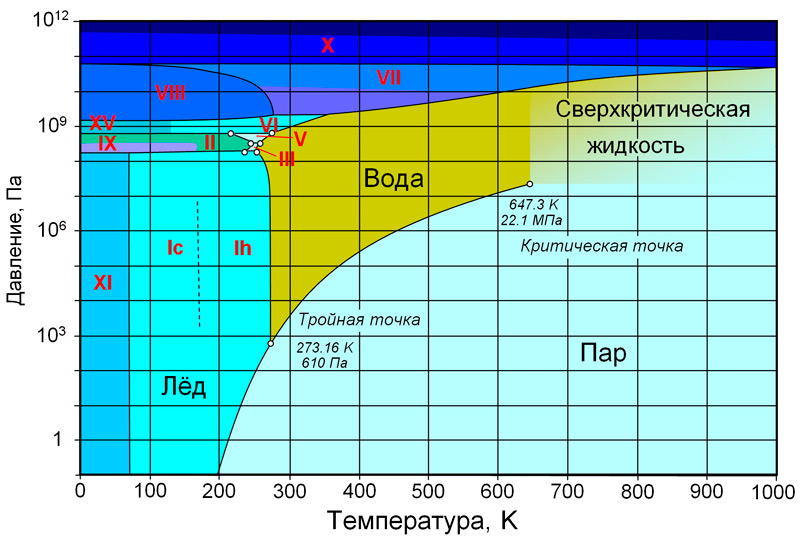
Илл. 6. Фазовая диаграмма воды с обозначением ледяных модификаций.
На пространственной схеме показан порядок в расположении водородных связей льда Ih, но в действительности связи выстраиваются случайным образом. Впрочем, ученые не исключают, что водородные связи на поверхности гексагонального льда более упорядочены, чем внутри структуры.
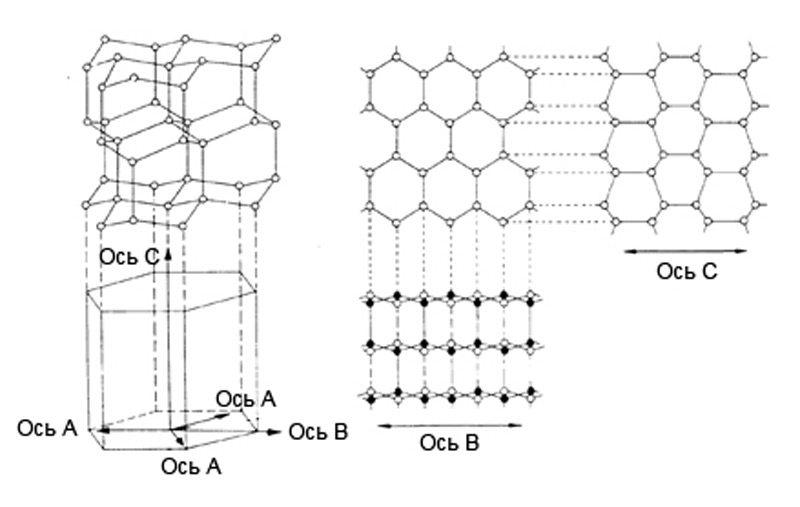
Илл. 8. Кристаллическая решетка льда Ih. Изометрия, виды сверху и сбоку.
Элементарная ячейка гексагонального льда (т.е. минимальный объем кристалла, повторное воспроизведение которого в трех измерениях, образует всю кристаллическую решетку в целом) включает в себя 4 молекулы воды. Размеры ячейки составляют 4,51 ? по сторонам a,b и 7.35 ? по стороне с (сторона, или ось с на схемах имеет вертикальное направление). Углы между сторонами, как видно из иллюстрации 4: a=v = 90°, g = 120°. Расстояние между соседними молекулами равно 2.76 ?.
Илл. 9. Элементарные ячейки льда Ih.
Гексагональные ледяные кристаллы образуют шестиугольные пластины и столбики; верхняя и нижняя грани в них являются базовыми плоскостями, а шесть одинаковых боковых граней называются призматическими (илл.10).
Минимальное количество молекул воды, необходимое для начала ее кристаллизации – около 275 (±25). В значительной степени образование льда происходит на поверхности водной массы, граничащей с воздухом, нежели внутри нее. Кристаллы крупнозернистого льда Ih медленно формируются в направлении оси с, например, в стоячей воде они растут вертикально вниз от кристаллических пластинок, или в условиях, где рост в сторону затруднен. Мелкозернистый лед, образующийся в неспокойной воде или при быстром ее замерзании, имеет ускоренный рост, направленный от призматических граней. Температура окружающей воды определяет степень разветвленности кристаллической решетки льда.
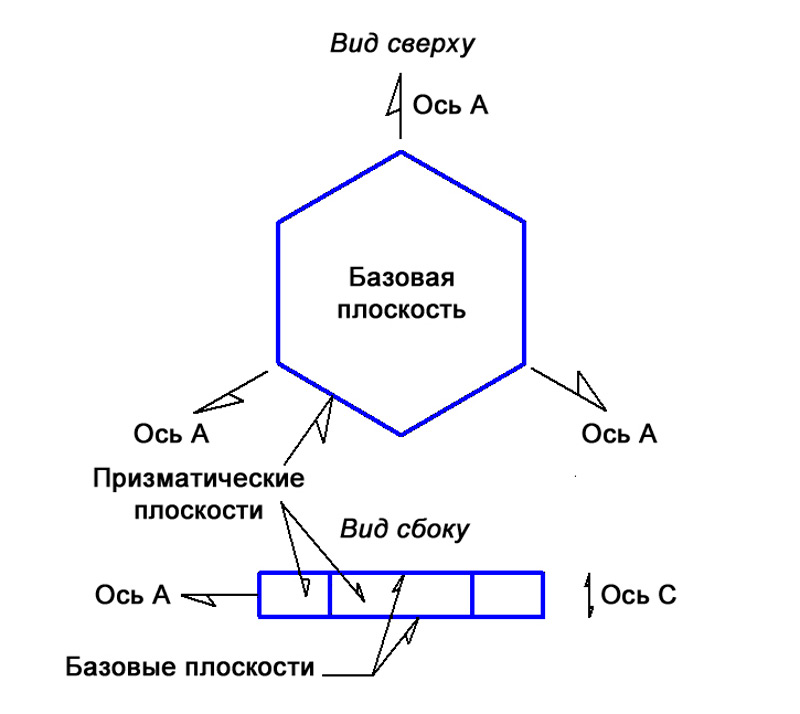
Илл. 10. Базовые и призматические плоскости гексагонального кристалла.
Частицы растворенных в воде веществ, за исключением атомов гелия и водорода, чьи размеры позволяют им поместиться в полостях структуры, при нормальном атмосферном давлении исключаются из кристаллической решетки, вытесняясь на поверхность кристалла или, как в случае с аморфной разновидностью (об этом дальше в статье) образуя слои между микрокристаллами. Последовательные циклы замораживания-оттаивания воды могут быть использованы для очистки ее от примесей, например, газов (дегазация).
Наряду со льдом Ih существует также лед Ic (кубическая сингония), правда, в природе образование этой разновидности льда изредка возможно только в верхних слоях атмосферы. Искусственно лед Ic получают путем моментального замораживания воды, для чего конденсируют пар на охлажденной от минус 80 до минус 110°С металлической поверхности при нормальном атмосферном давлении. В результате опыта на поверхность выпадают кристаллики кубической формы или в виде октаэдров. Создать кубический лед первой модификации из обычного гексагонального, понижая его температуру, не получится, а вот переход из кубического в гексагональный возможен при нагревании льда Ic выше минус 80°С.
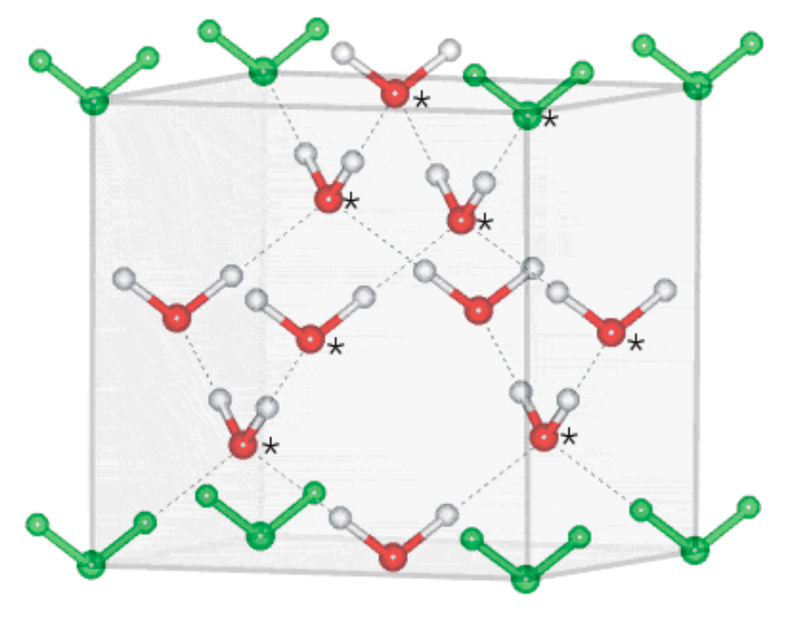
Илл. 11. Расположение молекул в кристалле кубического льда.
В молекулярной структуре льда Ic угол водородных связей такой же, как и у обычного льда Ih – 109.5°. А вот шестигранное кольцо, образуемое молекулами, в решетке льда Ic присутствует только в форме шезлонга.
Плотность льда Ic равна 0.92 г/см? при давлении в 1 атм. Элементарная ячейка в кубическом кристалле имеет 8 молекул и размеры: a=b=c = 6.35 ?, а ее углы a=v=g = 90°.
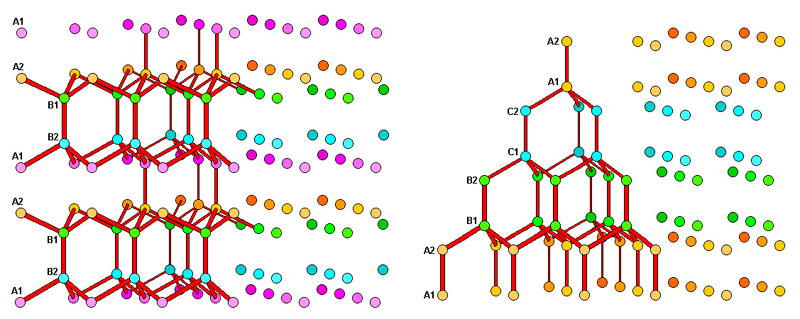
Илл. 12. Сравнение кристаллических решеток льда Ih (слева) и льда Ic.
Как вы поняли, в частности, из примера со льдом Ic, существование кристаллических модификаций льда возможно в условиях термодинамического равновесия, т.е. при нарушении баланса температуры и давления, определяющего наличие какого-либо кристаллического вида льда, этот вид исчезает, переходя в иную модификацию. Диапазон этих термодинамических значений различается, для каждого вида он свой. Рассмотрим другие типы льда, не строго в номенклатурном порядке, а в связи с этими структурными переходами.
Лед II относится к тригональной сингонии. Он может образоваться из гексагонального типа при давлении около 3 000 атм и температуре около минус 75°С, или из другой модификации (лед V), путем резкого снижения давления при температуре минус 35°С. Существование II типа льда возможно в условиях минус 170°С и давлении от 1 до 50 000 атм (или 5 гигапаскалей (ГПа)). По оценкам ученых, лед такой модификации, вероятно, может входить в состав ледяных спутников дальних планет Солнечной системы. Нормальное атмосферное давление и температура выше минус 113°C создают условия для перехода этого типа льда в обычный гексагональный лед.
Илл. 13. Кристаллическое строение II модификации.
Илл. 14. Молекулярные связки (гексамеры) в решетке льда II, одна из которых изогнута в форме шезлонга, другая почти плоская.
При нагреве II модификации можно получить лед III, и наоборот, охлаждение льда III превращает его в лед II. Также лед III образуется, когда температуру воды постепенно понижают до минус 23°С, увеличивая давление до 3 000 атм.
Как видно на фазовой диаграмме (илл. 6), термодинамические условия для стабильного состояния льда III, а также другой модификации – льда V, невелики.
Льды III и V имеют четыре тройные точки с окружающими модификациями (термодинамические значения, при которых возможно существование разных состояний вещества). Тем не менее, льды II, III и V модификаций могут существовать в условиях нормального атмосферного давления и температуры минус 170°С, а нагревание их до минус 150°С приводит к образованию льда Ic.
По сравнению с другими модификациями высокого давления, известными в настоящее время, лед III облает наименьшей плотностью – при давлении 3 500 атм. она равна 1.16 г/см?.
Лед III является тетрагональной разновидностью кристаллизованной воды, но сама структура решетки льда III имеет нарушения. Если обычно каждую молекулу окружают 4 соседние, то в данном случае этот показатель будет иметь значение 3.2, и кроме того поблизости могут находиться ещё 2 или 3 молекулы, которые не имеют водородных связей.
В пространственном построении молекулы образуют правосторонние спирали.
Габариты элементарной ячейки с 12 молекулами при минус 23°С и около 2800 атм: a=b = 6,66, c = 6,93 ?; a=v=g = 90°. Угол водородных связей в диапазоне от 87 до 141°.
На иллюстрации 15 условно представлена пространственная схема молекулярного строения льда III. Молекулы (точки голубого цвета), распложенные ближе к зрителю, показаны крупнее, а водородные связи (линии красного цвета) соответственно толще.

Илл. 15. Схема кристаллической решетки льда III.
Лед IV представляет собой метастабильное (слабоустойчивое) тригональное образование кристаллической решетки. Его существование возможно в фазовом пространстве льдов III, V и VI модификаций. Получить лед IV можно из аморфного льда высокой плотности, медленно нагревая его, начиная от минус 130°С при постоянном давлении 8 000 атм.
Размер элементарной ромбоэдрической ячейки составляет 7.60 ?, углы a=v=g = 70.1°. Ячейка включает в себя 16 молекул; водородные связи между молекулами асимметричные. При давлении 1 атм и температуре минус 163°С плотность льда IV равна 1.27 г/см?. Угол связей О–О–О: 88–128°.
Илл. 16. Структура льда IV типа.
Аналогично IV типу льда образуется и лед XII – путем нагревания высокоплотной аморфной модификации (об этом ниже) от минус 196 до минус 90°С при том же давлении 8 000 атм, но уже с более высокой скоростью.
Лед XII также метастабилен в фазовой области V и VI кристаллических типов. Является разновидностью тетрагональной сингонии.
Элементарная ячейка содержит 12 молекул, которые, благодаря водородным связям с углами 84–135°, располагаются в кристаллической решетке, образуя двойную правостороннюю спираль. Ячейка имеет размеры: a=b = 8.27, c = 4.02 ?; углы a=v=g = 90?. Плотность льда XII составляет 1.30 г/см? при нормальном атмосферном давлении и температуре минус 146°С. Углы водородных связей: 67–132°.
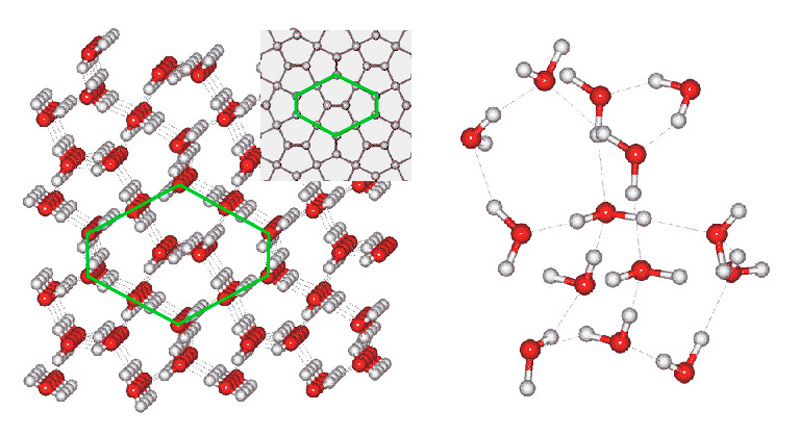
Илл. 17. Лед XII. Устройство решетки (слева) и расположение молекул.
Из открытых на сегодняшний день модификаций водяного льда самую сложную кристаллическую структуру имеет лед V. 28 молекул составляют его элементарную ячейку; водородные связи пролегают через зазоры в других молекулярных соединениях, а некоторые молекулы образуют связи только с определенными соединениями. Угол водородных связей между соседними молекулами сильно различается – от 86 до 132°, поэтому в кристаллической решетке льда V имеется сильное напряжение и огромный запас энергии.
Параметры ячейки при условиях нормального атмосферного давления и температуры минус 175°С: a= 9.22, b= 7.54, c= 10.35 ?; a=v = 90°, g = 109,2 °.
Лед V – это моноклинная разновидность, образуемая охлаждением воды до минус 20°С при давлении около 5 000 атм. Плотность кристаллической решетки с учетом давления 3 500 атм составляет 1.24 г/см?.
Пространственная схема кристаллической решетки льда V типа показана на иллюстрации 18. Серым контуром выделена область элементарной ячейки кристалла.

Илл. 18. Пространственная схема структуры льда V модификации.
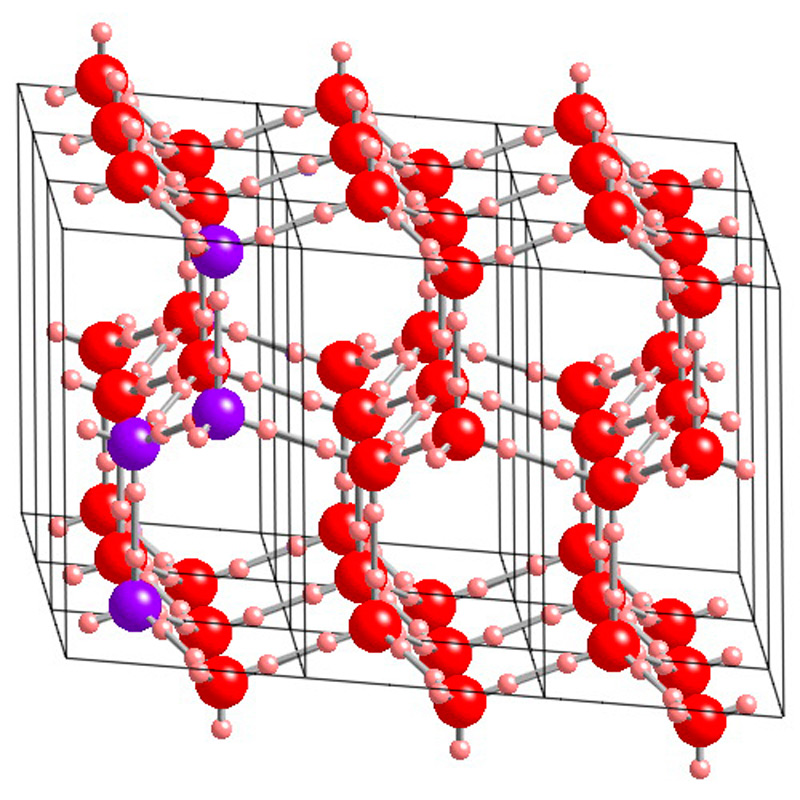
Упорядоченное расположение протонов в структуре льда V делает его другой разновидностью, именуемой льдом XIII. Данную моноклинную модификацию можно получить в результате охлаждения воды ниже минус 143°С с добавлением соляной кислоты (HCl) для облегчения фазового перехода, создавая давление 5 000 атм. Обратимый переход от XIII типа к V типу возможен в диапазоне температур от минус 193°С до минус 153°С.
Размеры элементарной ячейки льда XIII слегка отличаются от V модификации: а= 9,24, b= 7,47, c= 10.30 ?; a=v = 90°, g= 109,7 ° (при 1 атм, минус 193°С). Количество молекул в ячейке то же – 28. Угол водородных связей: 82–135°.
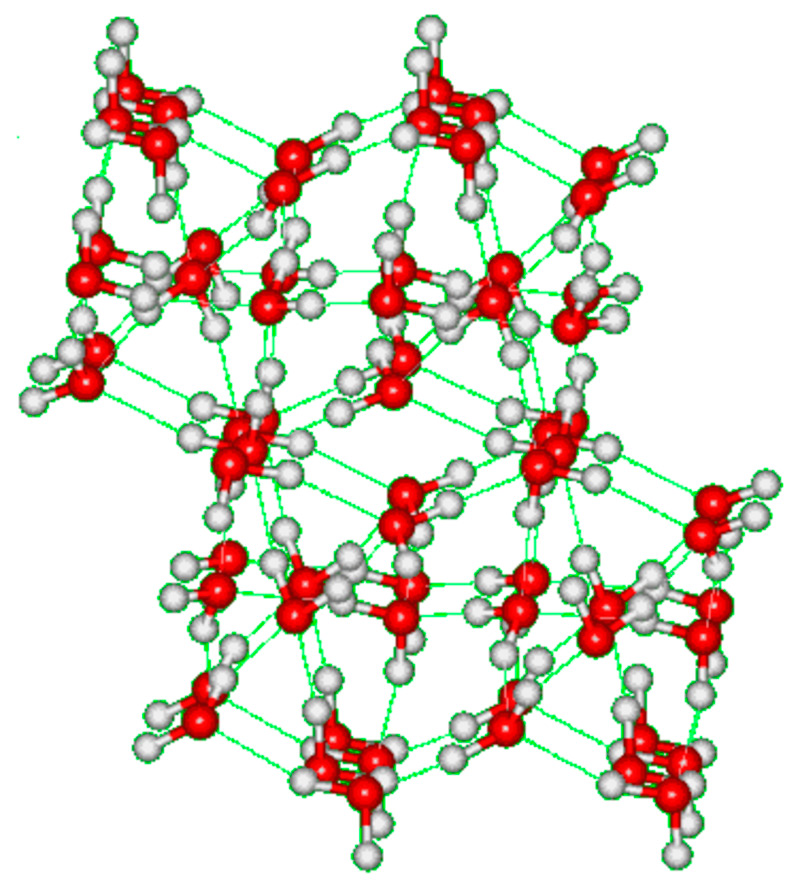
Илл. 19. Строение льда XIII.
В следующей части нашей статьи мы продолжим обзор модификаций водяного льда.
Мы все с вами привыкли видеть лед, держать его в руках, помним ощущения от прикосновения к холодной поверхности, знакомы с поведением льда, наблюдаем за процессом таяния и любуемся его прозрачностью. Но бывает ли другой лед, отличающийся от того, который мы знаем? Да, конечно бывает. Но давая более полный ответ на этот вопрос, нам следует его уточнить, так как существует несколько категорий, по которым мы можем различать тот или иной вид льда.
Во-первых, лед на Земле имеет различную природу происхождения – материковый лед, подземный, морской, атмосферный и т.д. А если говорить о разновидностях льда вне нашей планеты, то они серьезно отличаются от привычного нам, вследствие экстремальных условий в которых они образуются (читайте об этом в нашем разделе Космический лед ).
В-третьих, различают кристаллические решетки (модификации) водяного льда, образование которых обусловлено термодинамическим фактором. Вот о них-то мы и поговорим немного в этой заметке.

Илл. 1. Кристаллическая решетка водяного льда. Выделена базовая часть решетки – тетраэдр.
В статье Лед мы с вами остановились на том, как происходит перестройка структуры воды с изменением ее агрегатных состояний, и затронули кристаллическое строение обыкновенного льда. Благодаря внутреннему устройству самой молекулы воды и водородным связям, соединяющим все молекулы в упорядоченную систему, образуется гексагональная (шестиугольная) кристаллическая решетка льда. Ближайшие друг к другу молекулы (одна центральная и четыре угловых) расположены в форме трехгранной пирамиды, или тетраэдра, который лежит в основе гексагональной кристаллической модификации (илл.1).
Кстати, расстояние между мельчайшими частицами вещества измеряются в нанометрах (нм) или ангстремах (по имени шведского физика XIX века Андерса Йонаса Ангстрема; обозначается символом ?). 1 ? = 0,1 нм = 10-10 м.

Илл. 2. Шестиугольное строение ледяных кристаллов.
Такое шестиугольное строение обыкновенного льда распространяется на весь его объем. Наглядно в этом можно убедиться невооруженным глазом: зимой во время снегопада поймайте снежинку на рукав одежды или на перчатку и приглядитесь к ее форме – она шестилучевая или шестиугольная. Это характерно для каждой снежинки, но при этом ни одна снежинка никогда не повторяет другую (подробнее об этом в нашей статье Снежинки – микроледяные скульптуры ). И даже крупные кристаллы льда своей внешней формой отвечают внутреннему молекулярному строению (илл.2).

Илл. 3. Виды сингоний
Мы уже говорили, что переход вещества, в частности воды, из одного состояния в другое осуществляется при наличии определенных условий. Привычный лед образуется при температуре от 0°C и ниже и при давлении в 1 атмосферу (нормальное значение). Следовательно, для появления иных модификаций льда требуется изменение этих значений, и в большинстве случаев наличие низких температур и высокого давления, при которых происходит изменение угла водородных связей и реконструкция всей кристаллической решетки.

Илл. 4. Гексагональная сингония.
Каждая модификация льда относится к определенной сингонии – группе кристаллов, в которых элементарные ячейки обладают одной и той же симметрией и системой координат (оси XYZ). Всего же различают семь сингоний. Характеристики каждой из них представлены на иллюстрациях 3-4. А чуть ниже дано изображение основных форм кристаллов (илл.5)

Илл. 5. Формы кристаллов.
Все модификации льда, отличающиеся от обыкновенного, были получены в лабораторных условиях. О первых полиморфных структурах льда стало известно в начале XX века стараниями ученых Густава Таммана (Gustav Heinrich Tammann) и Перси Бриджмена (Percy Williams Bridgman). Диаграмма модификаций, составленная Бриджменом, периодически дополнялась. Новые модификации выявляли из полученных ранее. Последние изменения в диаграмму были внесены уже в наше время. На данный момент получено шестнадцать кристаллических типов льда. Каждый тип имеет свое наименование и обозначается римской цифрой.

Илл. 6. Фазовая диаграмма воды с обозначением ледяных модификаций.
На пространственной схеме показан порядок в расположении водородных связей льда Ih, но в действительности связи выстраиваются случайным образом. Впрочем, ученые не исключают, что водородные связи на поверхности гексагонального льда более упорядочены, чем внутри структуры.

Илл. 8. Кристаллическая решетка льда Ih. Изометрия, виды сверху и сбоку.
Элементарная ячейка гексагонального льда (т.е. минимальный объем кристалла, повторное воспроизведение которого в трех измерениях, образует всю кристаллическую решетку в целом) включает в себя 4 молекулы воды. Размеры ячейки составляют 4,51 ? по сторонам a,b и 7.35 ? по стороне с (сторона, или ось с на схемах имеет вертикальное направление). Углы между сторонами, как видно из иллюстрации 4: a=v = 90°, g = 120°. Расстояние между соседними молекулами равно 2.76 ?.

Илл. 9. Элементарные ячейки льда Ih.
Гексагональные ледяные кристаллы образуют шестиугольные пластины и столбики; верхняя и нижняя грани в них являются базовыми плоскостями, а шесть одинаковых боковых граней называются призматическими (илл.10).
Минимальное количество молекул воды, необходимое для начала ее кристаллизации – около 275 (±25). В значительной степени образование льда происходит на поверхности водной массы, граничащей с воздухом, нежели внутри нее. Кристаллы крупнозернистого льда Ih медленно формируются в направлении оси с, например, в стоячей воде они растут вертикально вниз от кристаллических пластинок, или в условиях, где рост в сторону затруднен. Мелкозернистый лед, образующийся в неспокойной воде или при быстром ее замерзании, имеет ускоренный рост, направленный от призматических граней. Температура окружающей воды определяет степень разветвленности кристаллической решетки льда.

Илл. 10. Базовые и призматические плоскости гексагонального кристалла.
Частицы растворенных в воде веществ, за исключением атомов гелия и водорода, чьи размеры позволяют им поместиться в полостях структуры, при нормальном атмосферном давлении исключаются из кристаллической решетки, вытесняясь на поверхность кристалла или, как в случае с аморфной разновидностью (об этом дальше в статье) образуя слои между микрокристаллами. Последовательные циклы замораживания-оттаивания воды могут быть использованы для очистки ее от примесей, например, газов (дегазация).
Наряду со льдом Ih существует также лед Ic (кубическая сингония), правда, в природе образование этой разновидности льда изредка возможно только в верхних слоях атмосферы. Искусственно лед Ic получают путем моментального замораживания воды, для чего конденсируют пар на охлажденной от минус 80 до минус 110°С металлической поверхности при нормальном атмосферном давлении. В результате опыта на поверхность выпадают кристаллики кубической формы или в виде октаэдров. Создать кубический лед первой модификации из обычного гексагонального, понижая его температуру, не получится, а вот переход из кубического в гексагональный возможен при нагревании льда Ic выше минус 80°С.

Илл. 11. Расположение молекул в кристалле кубического льда.
В молекулярной структуре льда Ic угол водородных связей такой же, как и у обычного льда Ih – 109.5°. А вот шестигранное кольцо, образуемое молекулами, в решетке льда Ic присутствует только в форме шезлонга.
Плотность льда Ic равна 0.92 г/см? при давлении в 1 атм. Элементарная ячейка в кубическом кристалле имеет 8 молекул и размеры: a=b=c = 6.35 ?, а ее углы a=v=g = 90°.

Илл. 12. Сравнение кристаллических решеток льда Ih (слева) и льда Ic.
Как вы поняли, в частности, из примера со льдом Ic, существование кристаллических модификаций льда возможно в условиях термодинамического равновесия, т.е. при нарушении баланса температуры и давления, определяющего наличие какого-либо кристаллического вида льда, этот вид исчезает, переходя в иную модификацию. Диапазон этих термодинамических значений различается, для каждого вида он свой. Рассмотрим другие типы льда, не строго в номенклатурном порядке, а в связи с этими структурными переходами.
Лед II относится к тригональной сингонии. Он может образоваться из гексагонального типа при давлении около 3 000 атм и температуре около минус 75°С, или из другой модификации (лед V), путем резкого снижения давления при температуре минус 35°С. Существование II типа льда возможно в условиях минус 170°С и давлении от 1 до 50 000 атм (или 5 гигапаскалей (ГПа)). По оценкам ученых, лед такой модификации, вероятно, может входить в состав ледяных спутников дальних планет Солнечной системы. Нормальное атмосферное давление и температура выше минус 113°C создают условия для перехода этого типа льда в обычный гексагональный лед.

Илл. 13. Кристаллическое строение II модификации.

Илл. 14. Молекулярные связки (гексамеры) в решетке льда II, одна из которых изогнута в форме шезлонга, другая почти плоская.
При нагреве II модификации можно получить лед III, и наоборот, охлаждение льда III превращает его в лед II. Также лед III образуется, когда температуру воды постепенно понижают до минус 23°С, увеличивая давление до 3 000 атм.
Как видно на фазовой диаграмме (илл. 6), термодинамические условия для стабильного состояния льда III, а также другой модификации – льда V, невелики.
Льды III и V имеют четыре тройные точки с окружающими модификациями (термодинамические значения, при которых возможно существование разных состояний вещества). Тем не менее, льды II, III и V модификаций могут существовать в условиях нормального атмосферного давления и температуры минус 170°С, а нагревание их до минус 150°С приводит к образованию льда Ic.
По сравнению с другими модификациями высокого давления, известными в настоящее время, лед III облает наименьшей плотностью – при давлении 3 500 атм. она равна 1.16 г/см?.
Лед III является тетрагональной разновидностью кристаллизованной воды, но сама структура решетки льда III имеет нарушения. Если обычно каждую молекулу окружают 4 соседние, то в данном случае этот показатель будет иметь значение 3.2, и кроме того поблизости могут находиться ещё 2 или 3 молекулы, которые не имеют водородных связей.
В пространственном построении молекулы образуют правосторонние спирали.
Габариты элементарной ячейки с 12 молекулами при минус 23°С и около 2800 атм: a=b = 6,66, c = 6,93 ?; a=v=g = 90°. Угол водородных связей в диапазоне от 87 до 141°.
На иллюстрации 15 условно представлена пространственная схема молекулярного строения льда III. Молекулы (точки голубого цвета), распложенные ближе к зрителю, показаны крупнее, а водородные связи (линии красного цвета) соответственно толще.

Илл. 15. Схема кристаллической решетки льда III.
Лед IV представляет собой метастабильное (слабоустойчивое) тригональное образование кристаллической решетки. Его существование возможно в фазовом пространстве льдов III, V и VI модификаций. Получить лед IV можно из аморфного льда высокой плотности, медленно нагревая его, начиная от минус 130°С при постоянном давлении 8 000 атм.
Размер элементарной ромбоэдрической ячейки составляет 7.60 ?, углы a=v=g = 70.1°. Ячейка включает в себя 16 молекул; водородные связи между молекулами асимметричные. При давлении 1 атм и температуре минус 163°С плотность льда IV равна 1.27 г/см?. Угол связей О–О–О: 88–128°.

Илл. 16. Структура льда IV типа.
Аналогично IV типу льда образуется и лед XII – путем нагревания высокоплотной аморфной модификации (об этом ниже) от минус 196 до минус 90°С при том же давлении 8 000 атм, но уже с более высокой скоростью.
Лед XII также метастабилен в фазовой области V и VI кристаллических типов. Является разновидностью тетрагональной сингонии.
Элементарная ячейка содержит 12 молекул, которые, благодаря водородным связям с углами 84–135°, располагаются в кристаллической решетке, образуя двойную правостороннюю спираль. Ячейка имеет размеры: a=b = 8.27, c = 4.02 ?; углы a=v=g = 90?. Плотность льда XII составляет 1.30 г/см? при нормальном атмосферном давлении и температуре минус 146°С. Углы водородных связей: 67–132°.

Илл. 17. Лед XII. Устройство решетки (слева) и расположение молекул.
Из открытых на сегодняшний день модификаций водяного льда самую сложную кристаллическую структуру имеет лед V. 28 молекул составляют его элементарную ячейку; водородные связи пролегают через зазоры в других молекулярных соединениях, а некоторые молекулы образуют связи только с определенными соединениями. Угол водородных связей между соседними молекулами сильно различается – от 86 до 132°, поэтому в кристаллической решетке льда V имеется сильное напряжение и огромный запас энергии.
Параметры ячейки при условиях нормального атмосферного давления и температуры минус 175°С: a= 9.22, b= 7.54, c= 10.35 ?; a=v = 90°, g = 109,2 °.
Лед V – это моноклинная разновидность, образуемая охлаждением воды до минус 20°С при давлении около 5 000 атм. Плотность кристаллической решетки с учетом давления 3 500 атм составляет 1.24 г/см?.
Пространственная схема кристаллической решетки льда V типа показана на иллюстрации 18. Серым контуром выделена область элементарной ячейки кристалла.

Илл. 18. Пространственная схема структуры льда V модификации.
Упорядоченное расположение протонов в структуре льда V делает его другой разновидностью, именуемой льдом XIII. Данную моноклинную модификацию можно получить в результате охлаждения воды ниже минус 143°С с добавлением соляной кислоты (HCl) для облегчения фазового перехода, создавая давление 5 000 атм. Обратимый переход от XIII типа к V типу возможен в диапазоне температур от минус 193°С до минус 153°С.
Размеры элементарной ячейки льда XIII слегка отличаются от V модификации: а= 9,24, b= 7,47, c= 10.30 ?; a=v = 90°, g= 109,7 ° (при 1 атм, минус 193°С). Количество молекул в ячейке то же – 28. Угол водородных связей: 82–135°.

Илл. 19. Строение льда XIII.
В следующей части нашей статьи мы продолжим обзор модификаций водяного льда.

Читайте также:
 webdonsk.ru
webdonsk.ru