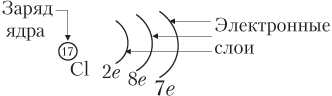Как сделать электронную конфигурацию меди
Химия — наука о веществах, их свойствах и превращениях.
Химическими веществами называют то, из чего состоит окружающий нас мир.
Свойства каждого химического вещества делятся на два типа: это химические, которые характеризуют его способность образовывать другие вещества, и физические, которые объективно наблюдаются и могут быть рассмотрены в отрыве от химических превращений. Так, например, физическими свойствами вещества являются его агрегатное состояние (твердое, жидкое или газообразное), теплопроводность, теплоемкость, растворимость в различных средах (вода, спирт и др.), плотность, цвет, вкус и т.д.
Превращения одних химических веществ в другие вещества называют химическими явлениями или химическими реакциями. Следует отметить, что существуют также и физические явления, которые, очевидно, сопровождаются изменением каких-либо физических свойств вещества без его превращения в другие вещества. К физическим явлениям, например, относятся плавление льда, замерзание или испарение воды и др.
О том, что в ходе какого-либо процесса имеет место химическое явление, можно сделать вывод, наблюдая характерные признаки химических реакций, такие как изменение цвета, образование осадка, выделение газа, выделение теплоты и (или) света.
Так, например, вывод о протекании химических реакций можно сделать, наблюдая:
— образование осадка при кипячении воды, называемого в быту накипью;
— выделение тепла и света при горении костра;
— изменение цвета среза свежего яблока на воздухе;
— образование газовых пузырьков при брожении теста и т.д.
Мельчайшие частицы вещества, которые в процессе химических реакций практически не претерпевают изменений, а лишь по-новому соединяются между собой, называются атомами.
Тем не менее, вопреки идее древнегреческих философов, атомы не являются абсолютным минимумом материи, т.е. сами имеют сложное строение.
Каждый атом состоит из так называемых субатомных частиц – протонов, нейтронов и электронов, обозначаемых соответственно символами p + , n o и e - . Надстрочный индекс в используемых обозначениях указывает на то, что протон имеет единичный положительный заряд, электрон – единичный отрицательный заряд, а нейтрон заряда не имеет.
Что касается качественного устройства атома, то у каждого атома все протоны и нейтроны сосредоточены в так называемом ядре, вокруг которого электроны образуют электронную оболочку.
Протон и нейтрон обладают практически одинаковыми массами, т.е. mp ? mn , а масса электрона почти в 2000 раз меньше массы каждого из них, т.е. mp/me ? mn/me ? 2000.
Поскольку фундаментальным свойством атома является его электронейтральность, а заряд одного электрона равен заряду одного протона, из этого можно сделать вывод о том, что количество электронов в любом атоме равно количеству протонов.
Так, например, в таблице ниже представлен возможный состав атомов:
| атом1 | атом2 | атом3 | атом4 | |
| ядро | 1p + | 1p + , 1n 0 | 4p + , 3n 0 | 4p + , 4n 0 |
| оболочка | 1e - | 1e - | 4e - | 4e - |
Вид атомов с одинаковым зарядом ядер, т.е. с одинаковым числом протонов в их ядрах, называют химическим элементом. Таким образом, из таблицы выше можно сделать вывод о том, что атом1 и атом2 относятся в одному химическому элементу, а атом3 и атом4 — к другому химическому элементу.
Как можно заметить из представленной выше таблицы, атомы одного химического элемента могут отличаться количеством нейтронов в ядрах.
Атомы, относящиеся к одному химическому элементу, но имеющие разное количество нейтронов и, как следствие массу, называют изотопами.
Так, например, химический элемент водород имеет три изотопа – 1 Н, 2 Н и 3 Н. Индексы 1, 2 и 3 сверху от символа Н означают суммарное количество нейтронов и протонов. Т.е. зная, что водород – это химический элемент, который характеризуется тем, что в ядрах его атомов находится по одному протону, можно сделать вывод о том, что в изотопе 1 Н вообще нет нейтронов (1-1=0), в изотопе 2 Н – 1 нейтрон (2-1=1) и в изотопе 3 Н – два нейтрона (3-1=2). Поскольку, как уже было сказано, нейтрон и протон имеют одинаковые массы, а масса электрона по сравнению с ними пренебрежимо мала, это значит, что изотоп 2 Н практически в два раза тяжелее изотопа 1 Н, а изотоп 3 Н — и вовсе в три раза. В связи с таким большим разбросом масс изотопов водорода изотопам 2 Н и 3 Н даже были присвоены отдельные индивидуальные названия и символы, что не характерно больше ни для одного другого химического элемента. Изотопу 2 Н дали название дейтерий и присвоили символ D, а изотопу 3 Н дали название тритий и присвоили символ Т.
Если принять массу протона и нейтрона за единицу, а массой электрона пренебречь, фактически верхний левый индекс помимо суммарного количества протонов и нейтронов в атоме можно считать его массой, в связи с чем этот индекс называют массовым числом и обозначают символом А. Поскольку за заряд ядра любого атома отвечают протоны, а заряд каждого протона условно считается равным +1, количество протонов в ядре называют зарядовым числом (Z). Обозначив количество нейтронов в атоме буквой N, математически взаимосвязь между массовым числом, зарядовым числом и количеством нейтронов можно выразить как:
Согласно современным представлениям, электрон имеет двойственную (корпускулярно-волновую) природу. Он обладает свойствами как частицы, так и волны. Подобно частице, электрон имеет массу и заряд, но в то же время поток электронов, подобно волне, характеризуется способностью к дифракции.
Для описания состояния электрона в атоме используют представления квантовой механики, согласно которым электрон не имеет определенной траектории движения и может находиться в любой точке пространства, но с разной вероятностью.
Область пространства вокруг ядра, где наиболее вероятно нахождение электрона, называется атомной орбиталью.
Атомная орбиталь может обладать различной формой, размером и ориентацией. Также атомную орбиталь называют электронным облаком.
Графически одну атомную орбиталь принято обозначать в виде квадратной ячейки:
Квантовая механика имеет крайне сложный математический аппарат, поэтому в рамках школьного курса химии рассматриваются только лишь следствия квантово-механической теории.
Согласно этим следствиям, любую атомную орбиталь и находящийся на ней электрон полностью характеризуют 4 квантовых числа.
- Главное квантовое число – n — определяет общую энергию электрона на данной орбитали. Диапазон значений главного квантового числа – все натуральные числа, т.е. n = 1,2,3,4, 5 и т.д.
- Орбитальное квантовое число — l – характеризует форму атомной орбитали и может принимать любые целочисленные значения от 0 до n-1, где n, напомним, — это главное квантовое число.
Орбитали с l = 0 называют s-орбиталями. s-Орбитали имеют сферическую форму и не обладают направленностью в пространстве:

Орбитали с l = 1 называются p-орбиталями. Данные орбитали обладают формой трехмерной восьмерки, т.е. формой, полученной вращением восьмерки вокруг оси симметрии, и внешне напоминают гантель:
Орбитали с l = 2 называются d-орбиталями, а с l = 3 – f-орбиталями. Их строение намного более сложное.
3) Магнитное квантовое число – ml – определяет пространственную ориентацию конкретной атомной орбитали и выражает проекцию орбитального момента импульса на направление магнитного поля. Магнитное квантовое число ml соответствует ориентации орбитали относительно направления вектора напряженности внешнего магнитного поля и может принимать любые целочисленные значения от –l до +l, включая 0, т.е. общее количество возможных значений равно (2l+1). Так, например, при l = 0 ml = 0 (одно значение), при l = 1 ml = -1, 0, +1 (три значения), при l = 2 ml = -2, -1, 0, +1, +2 (пять значений магнитного квантового числа) и т.д.
4) Спиновое квантовое число (или просто спин) — ms — условно можно считать отвечающим за направление вращения электрона в атоме, оно может принимать значения . Электроны с разными спинами обозначают вертикальными стрелками, направленными в разные стороны: ? и ?.
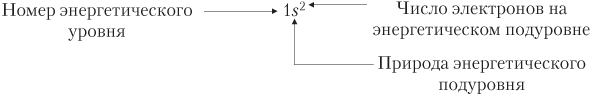
Совокупность всех орбиталей в атоме, имеющих одно и то же значение главного квантового числа, называют энергетическим уровнем или электронной оболочкой. Любой произвольный энергетический уровень с некоторым номером n состоит из n 2 орбиталей.
Множество орбиталей с одинаковыми значениями главного квантового числа и орбитального квантового числа представляет собой энергетический подуровень.
Каждый энергетический уровень, которому соответствует главное квантовое число n, содержит n подуровней. В свою очередь, каждый энергетический подуровень с орбитальным квантовым числом l, состоит из (2l+1) орбиталей. Таким образом, s-подуровень состоит из одной s-орбитали, p-подуровень – трех p-орбиталей, d-подуровень – пяти d-орбиталей, а f-подуровень — из семи f-орбиталей. Поскольку, как уже было сказано, одна атомная орбиталь часто обозначается одной квадратной ячейкой, то s-, p-, d- и f-подуровни можно графически изобразить следующим образом:
Каждой орбитали соответствует индивидуальный строго определенный набор трех квантовых чисел n, l и ml.
Распределение электронов по орбиталям называют электронной конфигурацией.
Заполнение атомных орбиталей электронами происходит в соответствии с тремя условиями:
-
Принцип минимума энергии: электроны заполняют орбитали, начиная с подуровня с наименьшей энергией. Последовательность подуровней в порядке увеличения их энергий выглядит следующим образом: 1s 2 2s 2 2p 6 3s 2 3p 3
Цифрами нормального размера слева от символа подуровня показан номер энергетического уровня, а верхними индексами справа от символа подуровня показано количество электронов на соответствующем подуровне.
Ниже приведены электронные формул первых 36 элементов периодической системы Д.И. Менделеева.
| период | № элемента | символ | название | электронная формула |
| I | 1 | H | водород | 1s 1 |
| 2 | He | гелий | 1s 2 | |
| II | 3 | Li | литий | 1s 2 2s 1 |
| 4 | Be | бериллий | 1s 2 2s 2 | |
| 5 | B | бор | 1s 2 2s 2 2p 1 | |
| 6 | C | углерод | 1s 2 2s 2 2p 2 | |
| 7 | N | азот | 1s 2 2s 2 2p 3 | |
| 8 | O | кислород | 1s 2 2s 2 2p 4 | |
| 9 | F | фтор | 1s 2 2s 2 2p 5 | |
| 10 | Ne | неон | 1s 2 2s 2 2p 6 | |
| III | 11 | Na | натрий | 1s 2 2s 2 2p 6 3s 1 |
| 12 | Mg | магний | 1s 2 2s 2 2p 6 3s 2 | |
| 13 | Al | алюминий | 1s 2 2s 2 2p 6 3s 2 3p 1 | |
| 14 | Si | кремний | 1s 2 2s 2 2p 6 3s 2 3p 2 | |
| 15 | P | фосфор | 1s 2 2s 2 2p 6 3s 2 3p 3 | |
| 16 | S | сера | 1s 2 2s 2 2p 6 3s 2 3p 4 | |
| 17 | Cl | хлор | 1s 2 2s 2 2p 6 3s 2 3p 5 | |
| 18 | Ar | аргон | 1s 2 2s 2 2p 6 3s 2 3p 6 | |
| IV | 19 | K | калий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 |
| 20 | Ca | кальций | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 | |
| 21 | Sc | скандий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 1 | |
| 22 | Ti | титан | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 2 | |
| 23 | V | ванадий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 3 | |
| 24 | Cr | хром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 25 | Mn | марганец | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 5 | |
| 26 | Fe | железо | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 6 | |
| 27 | Co | кобальт | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 7 | |
| 28 | Ni | никель | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 8 | |
| 29 | Cu | медь | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10 здесь наблюдается проскок одного электрона с s на d подуровень | |
| 30 | Zn | цинк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 | |
| 31 | Ga | галлий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 1 | |
| 32 | Ge | германий | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 2 | |
| 33 | As | мышьяк | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 3 | |
| 34 | Se | селен | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 4 | |
| 35 | Br | бром | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 5 | |
| 36 | Kr | криптон | 1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 10 4p 6 |
5B = 1s 2 2s 2 2p 1
5B* = 1s 2 2s 1 2p 2
В зависимости от того, какой подуровень в атоме заполняется последним, химические элементы делят на s, p, d или f.
Нахождение s, p, d и f-элементов в таблице Д.И. Менделеева:
- У s-элементов последний заполняемый s-подуровень. К данным элементам относятся элементы главных (слева в ячейке таблицы) подгрупп I и II групп.
- У p-элементов заполняется p-подуровень. К p-элементам относят последние шесть элементов каждого периода, кроме первого и седьмого, а также элементы главных подгрупп III-VIII групп.
- d-Элементы расположены между s – и p-элементами в больших периодах.
- f-Элементы называют лантаноидами и актиноидами. Они вынесены вниз таблицы Д.И. Менделеева.
Электронные конфигурации простых ионов
Ионами называют частицы, имеющие либо положительный, либо отрицательный заряд. Ионы бывают простые и сложные. Простые ионы образованы одним химическим элементом, сложные – двумя или более элементами.
Положительно заряженные ионы называют катионами, отрицательно заряженные ионы – анионами. Заряд иона обозначают надстрочным индексом, сначала указывая величину заряда, затем его знак. При этом в случае, если заряд иона по модулю равен единице, пишут только знак (+ или -).
Примеры простых ионов: Na + , Ca 2+ , Al 3+ , S 2- , I — и т.д.
Примеры сложных ионов: SO4 2- , NO3 — , [AlF6] 3- и т.д.
Рассмотрим детальнее простые ионы. Откуда у них может возникнуть заряд? Вспомним тот факт, что любой атом является электронейтральной частицей вследствие того, что количество отрицательно заряженных электронов в его оболочках равно количеству положительно заряженных протонов в его ядре.
Например, катион натрия Na + , от атома натрия Na 0 отличает то, что частица Na + содержит в себе на один электрон меньше чем, атом натрия. Для того чтобы записать электронную конфигурацию катиона натрия Na + , сначала вспомним, сколько электронов имеет атом натрия. Сделать мы это можем, взглянув на порядковый номер химического элемента в таблице Д.И. Менделеева. Натрий имеет порядковый номер 11, следовательно, его атом содержит 11 электронов, тогда катион натрия будет иметь на один электрон меньше, то есть 10 электронов.
Далее распределим 10 электронов по энергетическим подуровням, исходя из всех тех же принципов, что использовались для записи электронных конфигураций атомов:
Аналогично попробуем записать электронно-графическую формулу сульфид-иона S 2- . В таблице Д.И. Менделеева сера имеет порядковый номер, равный 16. Это значит, что атом серы S 0 содержит 16 электронов. Отрицательный заряд иона серы равный 2- указывает на то, что у этого иона на два электрона больше, чем у атома серы, то есть 18 электронов. Тогда электронно-графическая формула и обычная электронная формула сульфид-иона S 2- будут иметь вид:
Мы поняли, как записать электронно-графическую (или обычную электронную) формулу иона, зная точное его обозначение. Однако, для того чтобы успешно сдать ЕГЭ, нам нужно уметь самим определять заряды ионов, которые склонны образовывать те или иные химические элементы. Причем уметь определять заряд наиболее устойчивых ионов мы обязаны только для элементов главных подгрупп.
Например, определим, какой наиболее устойчивый ион образует магний. Смотрим в таблицу Д.И. Менделеева и видим, что ближайший по значению порядкового номера к нему благородный газ – неон. Атом неона содержит 10 электронов, значит и катион магния будет содержать 10 электронов, в то время как у обычного атома магния 12 электронов. Значит наиболее устойчивый катион магния будет иметь заряд 2+ (от 12 отнимаем 10), то есть мы можем обозначить его как Mg 2+ .
Перечень вопросов, рассматриваемых в теме: урок посвящён изучению основных металлов побочной подгруппы или Б-группы: меди, цинка, титана, хрома, железа, никеля и платины, их физическим и химическим свойствам, способам получения и применению.
Катализатор – вещество, которое ускоряет химическую реакцию.
Пассивация – переход металла в неактивное состояние из-за образования на его поверхности оксидной плёнки. Может усиливаться концентрированными кислотами.
Проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек.
Хромирование/никелирование – покрытие поверхности металла другим, более устойчивым, для предотвращения коррозии.
Цинковая обманка (ZnS) – сложно идентифицируемое соединение цинка, подверженное сильному влиянию примесей на ее внешний вид.
Основная литература: Рудзитис, Г. Е., Фельдман, Ф. Г. Химия. 10 класс. Базовый уровень; учебник/ Г. Е. Рудзитис, Ф. Г, Фельдман – М.: Просвещение, 2018. – 224 с.
Дополнительная литература:
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
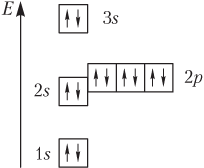
Медь является металлом, расположенным в I группе побочной подгруппе и имеет следующую электронную конфигурацию:

Рисунок 1 – Электронная конфигурация атома меди
Мы видим, что у меди наблюдается проскок электрона – отступление от общей для большинства элементов последовательности заполнения электронных оболочек. По принципу наименьшей энергии электронные орбитали должны заполняться в следующем порядке:
1s -> 2s -> 2p -> 3s -> 3p -> 4s -> 3d …
Но для некоторых атомов энергетически более выгодно иметь наполовину (5 электронов, дальше увидим у хрома) или полностью заполненную (10 электронов, как у меди) 3d-орбиталь.
Медь имеет две валентности: 1 и 2 и проявляет степени окисления +1 и +2.
Медь обладает следующими физическими свойствами
Таблица 1 – Основные физические свойства меди
Тягучая, вязкая, легко прокатывается
Температура плавления, °С
Нахождение в природе
В природе медь встречается в самородном виде, а также в составе некоторых минералов:
Способы получения меди
Основными способами получения меди являются:
- Восстановление коксом и оксидом углерода (II). Таким образом получают медь из куприта:
Cu2O + С = 2Сu + CO
- Обжиг в специальных печах до оксидов. Данный способ подходит для сульфидных и карбонатных руд.
- Электролиз. Единственный из перечисленных способов, который позволяет получить медь без примесей.
При комнатной температуре медь не вступает в реакции с большинством соединений. При повышенной температуре ее реакционная способность резко возрастает.
Реакции с простыми веществами:
Реакции со сложными веществами:
Широкое применение находит как сама медь, так и её соединения. В чистом виде она используется для производства проводов, кабелей, теплообменных аппаратов, а также входит в состав многих сплавов.
Соединения меди, например, медный купорос CuSO4?5H2O используется для защиты растений, а гидроксид меди является качественным реагентом для определения альдегидной группы у органических соединений, а также наличия глицерина (дает голубое окрашивание раствора).
Цинк является металлом, расположенным в II группе побочной подгруппе, и имеет следующую электронную конфигурацию:

Рисунок 2 – Электронная конфигурация атома цинка
В связи с тем, что 4s-орбиталь заполнена, цинк может находиться в единственной степени окисления, равной +2.
Цинк обладает следующими физическими свойствами
Таблица 2 – Основные физические свойства цинка
Температура плавления, °С
Нахождение в природе
В природе цинк встречается только в связанном состоянии, а именно в цинковом шпате ZnCO3 и цинковой обманке ZnS. Свое название цинковая обманка получила за то, что его сложно идентифицировать, поскольку он может выглядеть совершенно по-разному: быть различного цвета и структуры в зависимости от посторонних примесей.
Способы получения цинка
Чистый цинк получают обжигом с последующим восстановлением:
Цинк является довольно устойчивым металлом, поскольку на воздухе покрывается оксидной пленкой, и в дополнение практически не взаимодействует с водой при нормальных условиях. Но так же, как и медь, становится более активным при повышении температуры.
Реакции с простыми веществами:
Реакции со сложными веществами:
Цинк является коррозионно-устойчивым металлом, поэтому он нашёл применение в производстве защитных покрытий металлов, гальванических элементов, а также как компонент сплавов.
Титан является элементом IV группы побочной подгруппы и имеет следующее электронное строение:

Рисунок 3 – Электронная конфигурация атома титана
Данная конфигурация позволяет атому титана проявлять две степени окисления: +2 и +4.
Титан обладает следующими физическими свойствами:
Таблица 3 – Основные физические свойства титана
Высокая прочность и взякость
Температура плавления, °С
Нахождение в природе
В природе титан можно найти в составе таких минералов, как:
Способы получения титана
В связи с тем, что в природе не существует титановых руд, человеку приходится извлекать его путём хлорирования рудных концентратов с их последующим восстановлением с помощью магния или натрия.
Для удаления примесей магния и его соли полученную смесь продуктов нагревают под вакуумом.
Реакции с простыми веществами:
Азотная кислота действует на титан только в форме порошка, в то время как разбавленная серная кислота реагирует с металлом:
Титан и его сплавы отличает не только коррозионная стойкость, но и лёгкость, прочность. В связи с этим он активно используется при построении космических ракет, самолётов, подлодок и морских судов. Титан не взаимодействует с тканями организмов, из-за чего используется в хирургии.
Хром находится в IV группе побочной подгруппе и имеет следующее электронное строение:

Рисунок 4 – Электронная конфигурация атома хрома
Так как для атома хрома энергетически более выгодно иметь наполовину заполненную 3d-орбиталь, у него, как и у меди, наблюдается проскок электрона, что позволяет ему находиться в степенях окисления от +1 до +6, но наиболее устойчивыми являются +2, +3, +6.
Хром обладает следующими физическими свойствами:
Таблица 4 – Основные физические свойства хрома
Серебристо-белый с металлическим блеском
Температура плавления, °С
Нахождение в природе
В природе большая часть хрома заключена в составе хромистого железняка Fe(CrO2)2. Иногда может встречаться в виде оксида хрома (III) и других соединениях.
Способы получения хрома
Из хромистого железняка путем восстановлением углем при высоких температурах получают смесь железа и хрома – феррохром:
FeO + Cr2O3 + 3C = Fe + 2Cr + 3CO?
Для получения чистого хрома проводят восстановление оксида хрома (III) алюминием:
Как и все вышеописанные металлы, хром покрыт оксидной плёнкой, которую трудно растворить даже сильными кислотами. Благодаря ней он обладает высокой стойкости к коррозии, поэтому начинает реагировать с разбавленными растворами кислот лишь спустя время. Концентрированные кислоты, такие как HNO3 и H2SO4, пассивируют оксидную пленку (укрепляют ее).
Благодаря своей коррозионной стойкости, хром используют в качестве защитных покрытий (хромируют поверхности металлов и сплавов). Также используется для создания легированных сталей, речь о которых пойдет в следующем уроке.
Железо – металл, с которым мы чаще всего сталкиваемся в нашей жизни, поэтому переоценить его значимость для человека невозможно. Он является самым распространенным после алюминия и составляет 5% земной коры. Теперь перейдем к рассмотрению его строения и свойств.
Железо находится в VII группе Б-подгруппе и имеет такое электронное строение, которое позволяет ему находиться в двух степенях окисления: +2 и +3. Конечно, в теории железо может выступать в качестве шестивалентного металла, но из-за пространственных затруднений ему не удается образовать такое количество связей. Поэтому такое состояние является неустойчивым для данного металла.
Cu (медь) — элемент с прядковым номером 29 в периодической системе. Находится в IV периоде. Температура плавления: 1083.5 ?. Плотность: 8.92 г/см 3 .
Порядок заполнения орбиталей электронами в атоме Cu является исключением из правила Клечковского.
Ожидаемая электронная формула
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 9
Но в реальности происходит проскок одного электрона с орбитали 4s внешнего слоя на орбиталь 3d пред-внешнего слоя:
Электронная формула атома меди в порядке возрастания энергий орбиталей:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 10
Электронная формула атома меди в порядке следования уровней:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 1
Сокращенная электронная конфигурация Cu:
[Ar] 3d 10 4s 1
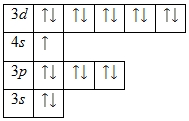
Ниже приведена электронно-графическая схема атома меди

Валентные электроны меди
Количество валентных электронов в атоме меди — 11.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
| Орбиталь | N | L | M | S |
|---|---|---|---|---|
| s | 4 | +1/2 | ||
| d | 3 | 2 | -2 | +1/2 |
| d | 3 | 2 | -1 | +1/2 |
| d | 3 | 2 | +1/2 | |
| d | 3 | 2 | 1 | +1/2 |
| d | 3 | 2 | 2 | +1/2 |
| d | 3 | 2 | -2 | -1/2 |
| d | 3 | 2 | -1 | -1/2 |
| d | 3 | 2 | -1/2 | |
| d | 3 | 2 | 1 | -1/2 |
| d | 3 | 2 | 2 | -1/2 |
Степени окисления, которые может проявлять медь: +1, +2, +3
Электронные формулы других элементов
2020 Ваш онлайн — калькуляторы, таблицы и формулы
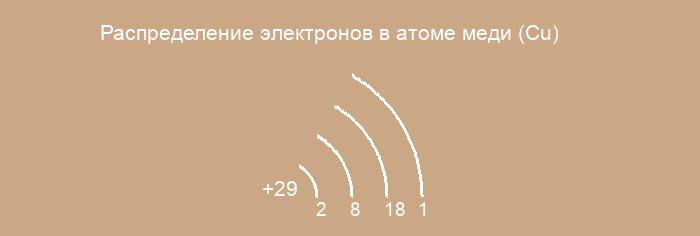
Строение атома меди
Общие сведения о строении атома меди
Относится к элементам d — семейства. Металл. Обозначение – Cu. Порядковый номер – 29. Относительная атомная масса – 63,546 а.е.м.
Электронное строение атома меди
Атом меди состоит из положительно заряженного ядра (+29), внутри которого есть 29 протонов и 35 нейтронов, а вокруг, по четырем орбитам движутся 29 электронов.

Рис.1. Схематическое строение атома меди.
Распределение электронов по орбиталям выглядит следующим образом:
Состояние считается более энергетически выгодным, если на d-подуровне находится 5 или 10 электронов, поэтому в случае меди мы наблюдаем проскок: один электрон s-подуровня переходит на d-подуровень для того, чтобы положение было устойчивым.
Энергетическая диаграмма основного состояния принимает следующий вид:
Примеры решения задач
| Задание | Сравните электронные конфигурации атомов азота и фосфора. Какие валентности и степени окисления они могут проявлять в химических соединениях? Приведите формулы соединений этих элементов с водородом и их высших оксидов. |
| Ответ | Дадим характеристику химическому элементу фосфору : |
- P – фосфор.
- Порядковый номер – 15. Элемент находится в 3 периоде, в V группе, А (главной) подгруппе.
- Z=15 (заряд ядра), M=31 (массовое число), e=15 (число электронов), p=15 (число протонов), n=31-15=16 (число нейтронов).
- 15P 1s 2 2s 2 2p 6 3s 2 3p 3 – электронная конфигурация, валентные электроны 3s 2 3p 3 .
- Основное состояние


Гидроксид, соответствующий высшему оксиду – H3PO4, проявляет кислотные свойства:
Дадим характеристику химическому элементу азоту :
- N – азот.
- Порядковый номер – 7. Элемент находится в 2 периоде, в V группе, А (главной) подгруппе.
- Z=7 (заряд ядра), M=14 (массовое число), e=7 (число электронов), p=7 (число протонов), n=14-7=7 (число нейтронов).
- 7N 1s 2 2s 2 2p 3 – электронная конфигурация, валентные электроны 2s 2 2p 3 .
- Основное состояние


Гидроксид, соответствующий высшему оксиду – HNO3, проявляет кислотные свойства:
| Задание | Приведите электронную формулу атома хрома. Сколько неспаренных электронов имеет атом хрома в основном состоянии? |
| Ответ | +24 Cr)2)8)13)1; |
Энергетическая диаграмма основного состояния принимает следующий вид:

Количество неспаренных электронов в атоме хрома равно шести.
Химия
Состояние электронов в атоме указывают, используя определенную форму записи. Например, для атома гелия имеем:
Распределение электронов в атоме указывают с помощью:
а) электронных схем , в которых отмечено только число электронов на каждом слое. Например: Mg 2 e , 8 e , 2 e ; Cl 2 e , 8 e , 7 e .
Часто употребляют графические электронные схемы, например, для атома хлора:
б) электронных конфигураций ; в этом случае показаны номер слоя (уровня), природа подуровней и число электронов на них. Например:
Mg 1 s 2 2 s 2 2 p 6 3 s 2 ;
в) электронно-графических схем , на которых орбитали изображают, например, в виде клетки, а электроны — стрелками (рис. 2.6).
Кроме полных формул электронных конфигураций, широко используются сокращенные. В этом случае часть электронной конфигурации, соответствующая благородному газу, указывается символом благородного газа в квадратных скобках. Например: 12 Mg[Ne]3 s 2 , 19 K[Ar]4 s 1 .
Существуют определенные принципы и правила заполнения электронами энергетических уровней и подуровней:
1. Принцип минимума полной энергии атома, согласно которому заселение электронами АО происходит так, чтобы полная энергия атома была минимальной. Экспериментально установлена следующая последовательность заполнения АО:
1 s -> 2 s -> 2 p -> 3 s -> 3 p -> 4 s -> 3 d -> 4 p . .
2. На одной АО может находиться не более двух электронов, причем их спины в этом случае должны быть антипараллельными.
3. В пределах данного энергетического подуровня электроны заполняют АО постепенно, вначале по одному (сначала все вакантные, а уже затем — по два), причем ориентация всех неспаренных электронов должна быть одинаковой, т.е. такой
Практически в любом атоме внешними являются только s — и p -АО (рис. 2.7), поэтому на внешнем электронном слое любого атома не может находиться более восьми электронов . Внешний электронный слой, содержащий восемь электронов (в случае гелия — два) называется завершенным .
Значения энергий разных энергетических подуровней для различных атомов не являются постоянными, а зависят от заряда ядра Z атома элемента: для атомов элементов с Z = 1–20 Е 3 d > E 4 s и Е 3 d > E 4 p ; для атомов элементов с Z >= 21 наоборот: Е 3 d E 4 s и Е 3 d E 4 p (рис. 2.8). Кроме того, чем больше Z , тем меньше различаются подуровни по энергии, а кривые, выражающие зависимость энергии подуровней от Z , пересекаются.
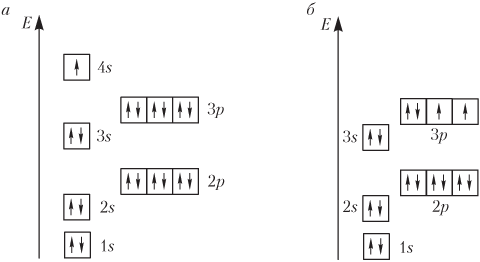
Электронные конфигурации атомов (основное состояние) K и Са следующие (см. рис. 2.8):
19 K: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 1 ,
20 Ca: 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 4 s 2 .
Начиная со скандия ( Z = 21) заполняется 3 d -подуровень, а во внешнем слое остаются 4 s -электроны. Общая электронная формула атомов элементов от Sс до Zn — 3 d 1-10 4 s 1-2 . Например:
Для хрома и меди наблюдается проскок (провал) 4 s -электрона на 3 d -подуровень: Cr — 3 d 5 4 s 1 , Cu — 3 d 10 4 s 1 . Такой проскок с ns — на ( n - 1) d -подуровень наблюдается также у атомов других элементов (Mo, Ag, Au, Pt) и объясняется близостью энергий ns — и ( n - 1) d -подуровней, а также стабильностью наполовину и полностью заполненных d -подуровней.
Дальше в 4-м периоде после 10 d -элементов следуют от Ga ([Ar] 3 d 10 4 s 2 4 p 1 ) до Kr ([Ar] 3 d 10 4 s 2 4 p 6 ) p -элементы.
Образование катионов d -элементов связано с потерей сначала внешних ns -, затем ( n - 1) d -электронов, например:
Ti: 3 d 2 4 s 2 -> - 2 e - Ti 2+ : 3 d 2 -> - 1 e - Ti 3+ : 3 d 1
Mn: 3 d 5 4 s 2 -> - 2 e - Mn 2+ : 3 d 5 -> - 2 e - Mn 4+ : 3 d 3
Отметим, что в формулах электронных конфигураций принято записывать сначала все электроны с меньшим значением n , а затем переходить к указанию электронов с более высоким значением главного квантового числа. Поэтому порядок заполнения и порядок записи энергетических подуровней для 3 d -элементов не совпадают. Например, в электронной формуле атома скандия 3 d -орбиталь указана до 4 s -орбитали, хотя раньше заполняется 4 s -орбиталь.
Возникает закономерный вопрос: почему в атомах 3 d -элементов раньше заполняется 4 s -подуровень, хотя его энергия больше энергии 3 d -подуровня? Почему, например, атом Sc не имеет в основном состоянии электронную конфигурацию 1 s 2 2 s 2 2 p 6 3 s 2 3 p 6 3 d 3 ?
Это происходит потому, что соотношение энергий различных электронных состояний атома не всегда совпадает с соотношением энергий отдельных энергетических подуровней. Энергия 4 s -подуровня для 3 d -элементов больше энергии 3 d -подуровня, но энергия состояния
[Ar] 3 d 1 4 s 2 меньше энергии состояния [Ar] 3 d 3 .
Объясняется это тем, что межэлектронное отталкивание, а соответственно и энергия всего состояния для конфигурации . 3 d 3 (с тремя электронами на одном и том же энергетическом подуровне) больше, чем для конфигурации . 3 d 1 4 s 2 (с тремя электронами, находящимися на разных энергетических уровнях).
Электронная конфигурация атома хрома (Cr)
Cr (хром) — элемент с прядковым номером 24 в периодической системе. Находится в IV периоде. Температура плавления: 1857 ?. Плотность: 7.14 г/см 3 .
Порядок заполнения орбиталей электронами в атоме Cr является исключением из правила Клечковского.
Ожидаемая электронная формула
1s 2 2s 2 2p 6 3s 2 3p 6 4s 2 3d 4
Но в реальности происходит проскок одного электрона с орбитали 4s внешнего слоя на орбиталь 3d пред-внешнего слоя:
Электронная формула атома хрома в порядке возрастания энергий орбиталей:
1s 2 2s 2 2p 6 3s 2 3p 6 4s 1 3d 5
Электронная формула атома хрома в порядке следования уровней:
1s 2 2s 2 2p 6 3s 2 3p 6 3d 5 4s 1
Сокращенная электронная конфигурация Cr:
[Ar] 3d 5 4s 1
Ниже приведена электронно-графическая схема атома хрома


Валентные электроны хрома
Количество валентных электронов в атоме хрома — 6.
Ниже приведены их квантовые числа (N — главное, L — орбитальное, M — магнитное, S — спин)
Записать распределение электронов по энергетическим уровням можно несколькими способами.
Запись по электронным оболочкам (схема электронного строения)
Показывает заряд ядра и количество электронов на каждом энергетическом уровне.

Запись с обозначением энергетических уровней и подуровней
Каждая орбиталь обозначается квадратной ячейкой. Электрон обозначается стрелкой. Различное направление стрелок указывает на противоположные спины.Под ячейкой подписывают номер энергетического уровня, буквенное обозначение орбитали и количество электронов на ней.





Электронная конфигурация атомов 1 и 2 периодов

Электронная конфигурация атомов 3 периода

Строение электронных оболочек атомов элементов третьего периода
Электронная конфигурация атомов 4 периода
Заполнение орбиталей атомов 4 периода имеет свои особенности.
На движение электрона влияют поле ядра и поле других электронов. Поэтому в атомах с большим количеством электронов энергия электрона определяется главным и орбитальным квантовыми числами.
Здесь уже надо смотреть на сумму обоих квантовых чисел (n+l). Если для двух подуровней эта сумма равна: 3d, 4p, 5s (n+l=5), то сначала заполняются уровни с меньшими значениями n. То есть последовательность заполнения будет следующей: 3d – 4p – 5s.
Поэтому в 4 периоде сначала заполняется подуровень 4s, а потом подуровень 3d.
Есть ещё одна особенность, которая появляется в 4 периоде. Хром и медь имеют на 4s-орбитали по одному электрону. Всё дело в заполнении d-оболочек. Полузаполненные или заполненные d-оболочки устойчивее частично заполненных. В атоме хрома на каждой из 5 3d-орбиталей есть по одному электрону. В атоме меди на каждой на каждой 3d-орбитали есть по два электрона.

Алгоритм записи электронной конфигурации атома
- По порядковому номеру химического элемента в таблице Менделеева определяем количество электронов в атоме.
- Распределяем электроны по энергетическим уровням, то есть составляем схему электронного строения.
- Выписываем s-, p-, d-подуровни в каждом энергетическом уровне.
- Заполняем подуровни электронами: сначала по одному электрону на орбиталь, потом достраиваем электронные пары.
Электронная конфигурация ионов
Электронная конфигурация ионов составляется по тем же принципам. Нужно учитывать изменения количества электронов на внешнем энергетическом уровне.
Атом электронейтрален, то есть сколько протонов ядре, столько же электронов в атоме. Если атом принимает электроны, он становится отрицательно заряженным ионом (анионом), если отдаёт электроны – положительно заряженным ионом (катионом).
Количество электронов на внешнем энергетическом уровне определяется по таблице Менделеева. У элементов главных подгрупп номер группы – это и есть количество электронов на внешнем уровне. У элементов побочных подгрупп количество электронов на внешнем уровне не больше двух.

Основное и возбуждённое состояния атома
На первый взгляд кажется, что атом хлора может образовывать только одну связь и соединения одного типа – например, хлориды. Но откуда берутся хлорная, хлорноватая, хлористая и хлорноватистая кислоты?
Дело в том, что атом можно перевести из основного состояния в возбуждённое.
Основное состояние – это состояние атома с наименьшей энергией. Атом обладает наименьшей энергией в основном состоянии. Но если ему передать дополнительную энергию, он перейдёт в возбуждённое состояние. Электроны перейдут на уровень или подуровень с большей энергией.

Сначала разрываются электронные пары на 3p-подуровне, электроны переходят на 3d-подуровень. Если атом хлора получит ещё больше энергии, спаренный электрон покинет даже 3s-орбиталь и перейдёт на 3d-подуровень.
Благодаря этому атом хлора может образовывать больше химических связей. Затраты энергии, потраченные на распаривание электронов, окупаются при образовании новых химических связей.
Но в возбуждённое состояние могут перейти атомы, у которых есть неспаренные электроны и свободные орбитали. Длится возбуждённое состояние недолго: атом отдаст энергию и вернётся в основное состояние. Хотя если сообщить атому слишком много энергии, электрон покинет его и атом станет ионом.

Читайте также: