Как сделать схему образования молекул
Добавил пользователь Владимир З. Обновлено: 08.10.2024
Молекула - это группировка взаимосвязанных атомов различных химических элементов. То есть атомы при сближении должны каким-то образом друг с другом связаться.
Первый способ - это ионная связь. Подробнее о нем Вы можете прочитать в статье "Что такое молекула. Просто о сложном".
Второй способ образования молекул из атомов состоит в следующем: при сближении нескольких атомов отдельные электроны, находящиеся на внешней электронной оболочке, престают принадлежать какому-то одному атому, а становятся общими (обменными) для двух атомов. Конечно речь опять идет о внешних электронах, внутренние остаются принадлежать своему "родному" атому. Подробнее о том, как расположены электроны внутри атома, Вы можете прочитать здесь.
Например, так группируется молекула углекислого газа. Она состоит из атома углерода и двух атомов кислорода. У углерода 4 внешних электрона, у кислорода - 6.
Возникает молекула следующим образом: углерод индивидуально себе оставляет 2 внутренних электрона, а четыре внешних электрона делятся на пары: одна пара электронов связывается с одним атомом кислорода, другая пара со вторым атомом кислорода. Связывается - значит эта пара электронов вращается и вокруг кислорода и вокруг углерода одновременно. Кислород конечно тоже не бездействует: на каждый "обмен" он отдает по два электрона.
Ну чтобы было понагляднее, я траекторию одного такого обменного электрона обвел пожирнее, остальные движутся аналогично.
Мы уже знаем, что в атомах электроны находятся на разрешенных энергетических состояниях – атомных орбиталях (АО). Аналогичным образом, электроны в молекулах существуют в разрешенных энергетических состояниях – молекулярных орбиталях (МО).
Молекулярная орбиталь
Молекулярная орбиталь устроена намного сложнее атомной орбитали. Приведем несколько правил, которыми мы будем руководствоваться при построении МО из АО:
- При составлении МО из набора атомных орбиталей, получается такое же число МО, сколько АО в данном наборе.
- Средняя энергия МО, полученных из нескольких АО, примерно равна (но может быть больше или меньшее) средней энергии взятых АО.
- МО подчиняются принципу запрета Паули: на каждой МО не может находиться более двух электронов, которые должны иметь противоположные спины.
- АО, которые обладают сопоставимой энергией, комбинируются наиболее эффективно.
- Эффективность, с которой комбинируют две атомные орбитали, пропорциональна их перекрыванию друг с другом.
- При образовании МО при перекрывании двух неэквивалентных АО связывающая МО содержит больший вклад АО с наиболее низкой энергией, а разрыхляющая орбиталь – вклад АО с более высокой энергией.
Введем понятие порядок связи. В двухатомных молекулах, порядок связи показывает насколько число связывающих электронных пар превышает число разрыхляющих электронных пар:

Теперь на примерах рассмотрим как строить молекулярные орбитали с применением этих правил.
Молекулярно-орбитальные диаграммы элементов первого периода
Диаграмма МО молекулы Н2
Пример образования молекулы водорода из двух атомов водорода.
В результате взаимодействия 1s-орбиталей каждого из атомов водорода, образуются две молекулярные орбитали.
При взаимодействии, когда электронная плотность концентрируется в пространстве между ядрами, образуется связывающая сигма – орбиталь (s). Эта комбинация имеет более низкую энергию, чем исходные атомы. При взаимодействии, когда электронная плотность концентрируется за пределами межъядерной области, образуется разрыхляющая сигма – орбиталь (s * ). Эта комбинация имеет более высокую энергию, чем исходные атомы.
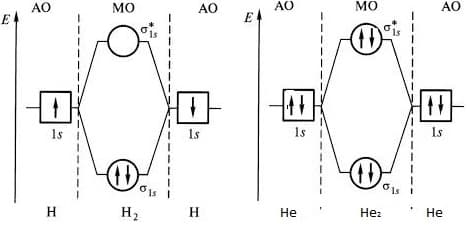
диаграммы МО молекул водорода и гелия
Электроны, в соответствии с принципом Паули, занимают сначала орбиталь с самой низкой энергией s-орбиталь.
Диаграмма МО молекулы Не2
Теперь рассмотрим пример образования молекулы гелия He2, при сближении двух атомов гелия. В этом случае тоже происходит взаимодействие 1s-орбиталей и образование и s * -орбиталей, при этом два электрона занимают связывающую орбиталь, а другие два электрона – разрыхляющую.
s * — орбиталь дестабилизирована в такой же мере, насколько стабилизирована s –орбиталь, поэтому два электрона, занимающие s * — орбиталь, дестабилизируют молекулу He2. Действительно, экспериментально доказано, что молекула He2 очень неустойчива.
Как узнать несколько велика прочность молекулы? Чем больше разница в заполненности связывающей и разрыхляющей орбиталей, тем молекула более прочная. Как видно из диаграммы разница в заполненности орбиталей молекулы водорода больше, чем молекулы гелия, поэтому молекула водорода намного более прочная, чем молекула гелия.
Молекулярно-орбитальные диаграммы элементов второго периода
Рассмотрим, как взаимодействуют два одинаковых атома второго периода между собой, имеющие набор из s- и p-орбиталей. Следует ожидать, что 2s-орбитали будут соединяться только друг с другом, а 2p-орбитали – только с а 2p-орбиталями.
Т.к. 2p-орбитали могут взаимодействовать друг с другом двумя различными способами, то образуют s- и p-молекулярные орбитали. Пользуясь обобщенной диаграммой, показанной ниже, можно установить электронные конфигурации двухатомных молекул второго периода , которые приведены в таблице.

Так, образование молекулы, например, фтора F2 из атомов в системе обозначений теории молекулярных орбиталей может быть записано следующим образом:
Т.к. перекрывание 1s-облаков незначительно, то участием электронов на этих орбиталях можно пренебречь. Тогда электронная конфигурация молекулы фтора будет такой:
где К — электронная конфигурация К-слоя.
В таблице приведены молекулярные орбитали двухатомных молекул элементов второго периода бора (B2), углерода (C2), азота (N2), кислорода (O2), фтора (F2)

Рассмотрим подробнее пример образования молекулы лития Li2, принимая во внимание, что 1s- и 2s-орбитали слишком сильно отличаются по энергии и поэтому между ними не возникает сильного взаимодействия.
Диаграмма энергетических уровней молекулы Li2 показана ниже, где электроны, находящиеся на 1s-связывающих и 1s-разрыхляющих орбиталях не вносят значительного вклада в связывание. Поэтому за образование химической связи в молекуле Li2 отвечают 2s-электроны.
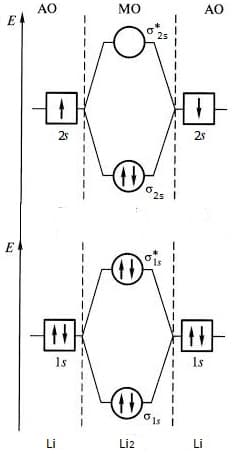
диаграмма МО молекулы лития
Это действие распространяется и на образование других молекул, в которых заполненные атомные подоболочки (s, p, d) не дают вклада в химическую связь. Таким образом, рассматриваются только валентные электроны.
В итоге, для щелочных металлов, молекулярно-орбитальная диаграмма будет иметь вид подобный рассмотренной нами диаграмме молекулы Li2.
Порядок связи n в молекуле Li2 равен 1
Молекулярные орбитали полярных двухатомных молекул
Учение о МО позволяет объяснить и образование двухатомных гетероядерных молекул. Если атомы в молекуле не слишком отличаются друг от друга (например, NO, CO, CN), то можно воспользоваться диаграммой, приведенной выше для элементов 2 периода.
При значительных различиях между атомами, входящих в состав молекулы, диаграмма видоизменяется.
Чем больше электроотрицательность атома, тем более низко на диаграмме обозначают атомные орбитали.
Диаграмма МО молекулы HF
Рассмотрим молекулу HF, в которой атомы сильно отличаются по электроотрицательности.
Энергия 1s-орбитали атома водорода выше энергии самой высокой из валентных орбиталей фтора – 2p — орбитали. Взаимодействие 1s-орбитали атома водорода и 2p — орбитали фтора приводит к образованию связывающей и разрыхляющей орбиталей, как показано на рисунке. Пара электронов, находящиеся на связывающей орбитали молекулы HF, образуют полярную ковалентную связь.
Для связывающей орбитали молекулы HF 2p — орбиталь атома фтора играет более важную роль, чем 1s — орбиталь атома водорода.
Для разрыхляющей орбитали молекулы HF наоборот: 1s — орбиталь атома водорода играет более важную роль, чем 2p — орбиталь атома фтора
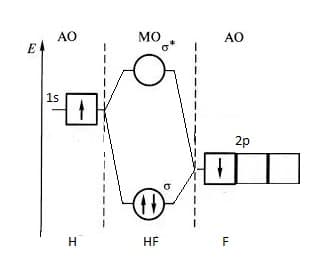
Диаграмма МО молекулы HF
Т.к. электроотрицательность фтора больше, чем электроотрицательность водорода, то на диаграмме, атомные орбитали фтора расположени ниже, чем атомная орбиталь водорода.
Определим порядок связи, т.е. кратность связи:
Т.о. в молекуле H-F связь одинарная.
Диаграмма МО молекулы СО
Электронная конфигурация внешнего слоя атомов углерода и кислорода:
С+6 1s 2 2s 2 2p 2
O+8 1s 2 2s 2 2p 4
Кислород более электроотрицательный элемент, поэтому его атомная орбиталь на диаграмме расположена ниже орбитали углерода.
Диаграмма МО молекулы СО имеет вид:

Кратность связи равна:
Диаграмма молекулы NO приведена в разделе Задачи к разделу Химическая связь и строение молекул
Хронологически метод молекулярных орбиталей появился позже метода валентных связей, поскольку оставались в теории ковалентной связи вопросы, которые не могли получить объяснение методом ВС. Укажем некоторые из них.
Как известно, основное положение метода ВС состоит в том, что связь между атомами осуществляется за счет электронных пар (связующих двухэлектронных облаков). Но это не всегда так. В ряде случаев в образовании химической связи участвуют отдельные электроны. Так, в молекулярном ионе Н2 + одноэлектронная связь. Метод ВС образование одноэлектронной связи объяснить не может, она противоречит его основному положению.
Метод ВС не объясняет также роли неспаренных электронов в молекуле. Молекулы, имеющие неспаренные электроны, парамагнитны, т. е. втягиваются в магнитное поле, так как неспаренный электрон создает постоянный магнитный момент. Если в молекулах нет неспаренных электронов, то они диамагнитны – выталкиваются из магнитного поля. Молекула кислорода парамагнитна, в ней имеется два электрона с параллельной ориентацией спинов, что противоречит методу ВС. Необходимо также отметить, что метод ВС не смог объяснить ряд свойств комплексных соединений – их цветность и др.
Чтобы объяснить эти факты, был предложен метод молекулярных орбиталей (ММО).
4.5.1. Основные положения ММО, МО.
1. В молекуле все электроны являются общими. Сама молекула — это единое целое, совокупность ядер и электронов.
2. В молекуле каждому электрону соответствует молекулярная орбиталь, подобно тому как каждому электрону в атоме соответствует атомная орбиталь. И обозначения орбиталей аналогичны:

3. В первом приближении молекулярная орбиталь представляет собой линейную комбинацию (сложение и вычитание) атомных орбиталей. Поэтому говорят о методе молекулярных орбиталей ЛКАО (молекулярная орбиталь есть линейная комбинация атомных орбиталей), при которой из N АО образуется N МО (это основное положение метода).

Рис. 12. Энергетическая схема образования молекулы водорода Н2
Рассмотрение химических связей в методе молекулярных орбиталей заключается в распределении электронов в молекуле по ее орбиталям. Последние заполняются в порядке возрастания энергии и с учетом принципа Паули. В этом методе предполагается увеличение электронной плотности между ядрами при образовании ковалентной связи.
Пользуясь положениями 1—3, объясним образование молекулы H2 с точки зрения метода молекулярных орбиталей. При достаточном сближении атомов водорода происходит перекрывание их электронных орбиталей. Согласно п. 3 из двух одинаковых ls-орбиталей образуются две молекулярные орбитали: одна из них от сложения атомных орбиталей, другая от их вычитания (рис.12). Энергия первой E1 св ), а находящиеся на ней электроны—связывающими электронами.
Молекулярная орбиталь, энергия которой больше энергии атомной орбитали, называется антисвязывающей или разрыхляющей (обозначается символом разр ), а находящиеся на ней электроны — разрыхляющими электронами.
Если у соединяющихся атомов водорода спины электронов антипараллельны, то они займут связывающую молекулярную орбиталь, возникает химическая связь (рис. 12), сопровождающаяся выделением энергии E1 (435 кДж/моль). Если же спины электронов атомов водорода параллельны, то они в соответствии с принципом Паули не могут разместиться на одной молекулярной орбитали: один из них разместится на связывающей, а другой на разрыхляющей орбитали, значит химическая связь образоваться не может.
Согласно методу молекулярных орбиталей образование молекул возможно, если число электронов на связывающих орбиталях больше числа электронов на разрыхляющих орбиталях. Если же число электронов на связывающих и разрыхляющих орбиталях одинаково, то такие молекулы образоваться не могут. Так, теория не допускает существования молекулы Нe2, так как в ней два электрона находились бы на связывающей орбитали и два — на разрыхляющей. Всегда разрыхляющий электрон сводит на нет действие связывающего электрона.
В системе обозначений метода молекулярных орбиталей реакцию образования молекулы водорода из атомов записывают так:
2H[1s 1 ] = H2[(s CB 1s) 2 ],
т. е. используются символы, выражающие размещение электронов на атомных и молекулярных орбиталях. При этом символ каждой молекулярной орбитали заключается в круглые скобки и над скобками справа проставляется число электронов на этой орбитали.
Число валентных связей определяется по формуле:

В молекуле водорода В = (2—0) : 2=1, водород одновалентен. Молекула Н2 диамагнитна (электроны спарены).
Теперь легко объясняется одноэлектронная связь в молекулярном ионе Н2 + (рис.13). Единственный электрон этого иона занимает энергетически наиболее выгодную орбиталь св 1s. Уравнение процесса:
H[1s 1 ] + H + = H2 + [(s св 1s) 1 ], ?H = – 259,4 кДж

Число связей в ионе H2 + равно 1/2 (связь одним электроном). Ион H2 + — парамагнитен (имеет один неспаренный электрон).
Возможно существование молекулярного дигелий иона Не2 + (рис.14). Уравнение его образования
He[1s 2 ] + He + [1s 1 ] = He2 + [(s CB 1s) 2 (s разр 1s) 1 ], ?H = – 292,8 кДж
Этот ион экспериментально обнаружен. Число связей в нем (2—1) : 2 = 1 /2. Ион— парамагнитен (имеет неспаренный электрон).

Рис. 15 . Энергетическая схема образования двухатомных гомонуклеарных молекул элементов второго периода
4.5.2. Основные двухатомные гомонуклеарные молекулы элементов 2-го периода. Рассмотренный принцип построения молекулярных орбиталей из двух одинаковых АО сохраняется при построении гомонуклеарных молекул элементов 2-го периода системы Д.И. Менделеева. Они образуются в результате взаимодействия 2s- и 2рx-, 2рy– и 2рz-орбиталей.
Участием внутренних электронов 1s-орбиталей можно пренебречь (на последующих энергетических схемах они не учтены). 2s-орбиталь одного атома взаимодействует только с 2s-орбиталью другого атома (должна быть близость значений энергий взаимодействующих орбиталей), образуя МО s2s св и s2s разр . При перекрывании (взаимодействии) 2р-орбиталей обоих атомов образуются МО: sх св , sх разр , pу св , pу разр , pz св , pz разр
(рис.15). Т.е. из шести исходных 2р-орбиталей образуется шесть молекулярных орбиталей – три связывающих и три разрыхляющих. Молекулярные орбитали, образующиеся из s- и рx-атомных орбиталей, обозначаются буквой , а из ру– и рz– – буквой . С помощью рис. 15 легко представить электронные конфигурации этих молекул в системе обозначений метода молекулярных орбиталей.

Рис. 16. Энергетическая схема образования молекулы Li2
Пример 1. Молекула лития Li2. Схема ее образования представлена на рис.16. В ней два связывающих электрона, молекула диамагнитна (электроны спарены). Написание уравнения и формулы можно упростить, обозначив внутренний уровень через K:
2Li[K2s] = Li2[KK(s CB 2s) 2 ]
Число связей равно 1.
Пример 2. Молекула бериллия Be2. Восемь электронов молекулы размещены на МО следующим образом:
Ве2[KK(s CB 2s) 2 (s разр 2s) 2 ]
Как видно, число связей в молекуле равно нулю: два разрыхляющих электрона уничтожают действие двух связывающих. Такая молекула не может существовать, и она до сих пор не обнаружена. Необходимо отметить, что невозможны двухатомные молекулы у всех элементов IIА-группы, палладия и инертных элементов, так как их атомы имеют замкнутую электронную структуру.
Пример 3. Молекула азота N2 (рис. 17). Распределение 14 электронов по МО записывается так:


Рис. 17. Энергетическая схема образования молекулы N2
Под формулой указано число связей в молекуле, исходя из расчета, что два электрона, расположенные на одной МО, образуют валентную связь; знак плюс обозначает связующие орбитали, знак минус – разрыхляющие. Число связей в молекуле 3. нет неспаренных электронов – молекула диамагнитна.
Пример 4. Молекула O2 (рис. 18). Электроны размещаются по молекулярным орбиталям в последовательности:
В молекуле две валентные связи. Последние два электрона разместились на различных p-разрыхляющих орбиталях в соответствии с правилом Гунда. Два неспаренных электрона обусловливают парамагнетизм молекулы кислорода.


Рис. 18. Энергетическая схема образования молекулы O2
4.5.3. Двухатомные гетеронуклеарные молекулы элементов 2-го периода. Энергетическая схема образования МО гетеронуклеарных двухатомных молекул, состоящих из атомов элементов 2-го периода, представлена на рис. 19. Она сходна со схемой образования молекулярных орбиталей гомонуклеарных молекул.
Основное различие сводится к тому, что значения энергии одноименных орбиталей атомов разных элементов не равны между собой, поскольку различны заряды ядер атомов. В качестве примера рассмотрим электронную валентную конфигурацию молекул СО и NO.

Рис. 19 . Энергетическая схема образования двух атомных гетеронуклеарных молекул элементов второго периода
Пример 5.Молекула СО. Внешняя электронная оболочка атома углерода имеет конфигурацию 2s 2 2p 2 , а кислорода 2s 2 2p 4 . Стало быть, в заполнении МО молекулы СО принимают участие 4+6=10 электронов. Из них два размещаются на орбитали s2s св , два – на орбитали s2s разр , четыре – на орбиталях py CB и pz CB , а девятый и десятый – на sх св . Таким образом, электронную валентную конфигурацию молекулы СО можно выразить формулой:

Как и предусматривалось теорией ВС, в молекуле СО три валентные связи (сравните с N2). Молекула диамагнитна – все электроны спарены.
Пример 6. Молекула NO. На МО молекулы оксида азота (II) должны разместиться 11 электронов: пять азота – 2s 2 2p 3 и шесть кислорода – 2s 2 2p 4 . Десять из них размещаются так же, как и электроны молекулы оксида углерода (II) (пример 5), а одиннадцатый разместится на одной из разрыхляющих орбиталей – py разр или pZ разр (эти орбитали энергетически эквивалентны между собой). Тогда
Значит, молекула NO имеет две с половиной валентные связи, энергия связи большая —677,8кДж/моль. Она парамагнитна, так как содержит один неспаренный электрон.

Приведенные примеры служат иллюстрацией возможностей метода МО в объяснении строения и свойств молекул.
Пример 7. Какую валентность, обусловленную неспаренными электронами (спинвалентность), может проявлять фосфор в нормальном и возбужденном состояниях?
Решение. Распределение электронов внешнего энергетического уровня фосфора 3s 2 3р 3 (учитывая правило Хунда, ) по квантовым ячейкам имеет вид:

Атомы фосфора имеют свободные d-орбитали, поэтому возможен переход одного 3s-электрона в 3d-состояние:

Отсюда валентность (спинвалентность) фосфора в нормальном состоянии равна трем, а в возбужденном — пяти.
Пример 8. Что такое гибридизация валентных орбиталей? Какое строение имеют молекулы типа АВn, если связь в них образуется за счет sp-, sp 2 -, sp 3 -гибридизации орбиталей атома А?
Решение. Теория валентных связей (ВС) предполагает участие в образовании ковалентных связей не только чистых АО, но и смешанных, так называемых гибридных, АО. При гибридизации первоначальная форма и энергия орбиталей (электронных облаков) взаимно изменяются и образуются орбитали (облака) новой одинаковой формы и с одинаковой энергией. Число гибридных орбиталей (q) равно числу исходных. Ответ см. в табл. 13.
Гибридизация орбиталей и пространственная конфигурация молекул

Пример 9. Как метод молекулярных орбиталей (МО) описывает строение двухатомных гомоядерных молекул элементов второго периода?
Решение. Метод валентных связей (ВС) не может объяснить целый ряд свойств и строение некоторых молекул (парамагнетизм молекулы О2; большую прочность связей в молекулярных ионах F + 2 и О + 2, чем, соответственно, в молекулах F2 и O2; наоборот, меньшую прочность связи в ионе N + 2 , чем в молекуле N2; существование молекулярного иона Не2 + и неустойчивость молекулы Не2 и т.п.). Более плодотворным оказался другой подход к объяснению ковалентной связи — метод молекулярных орбиталей (МО). В методе МО состояние молекулы описывается как совокупность электронных молекулярных орбиталей. При этом число молекулярных орбиталей равно сумме атомных орбиталей. Молекулярной орбитали, возникающей от сложения атомных орбиталей (АО), соответствует более низкая энергия, чем исходным орбиталям. Такая МО имеет повышенную электронную плотность в пространстве между ядрами, способствует образованию химической связи и называется связывающей. Молекулярной орбитали, образовавшейся от вычитания атомной, соответствует более высокая энергия, чем атомной орбитали. Электронная плотность в этом случае сконцентрирована за ядрами атомов, а между ними равна нулю. Подобные МО энергетически менее выгодны, чем исходные АО, они приводят к ослаблению химической связи и называются разрыхляющими. Электроны, занимающие связывающие и разрыхляющие орбитали, называют соответственно связывающими (cв) и разрыхляющими (разр). Заполнение молекулярных орбиталей происходит при соблюдении принципа Паули и правила Хунда по мере увеличения их энергии в такой последовательности:
s CB 1s разр 1s CB 2s разр 2s CB 2px CB 2py =
На рис. 20 изображена энергетическая схема образования молекулярных орбиталей из атомных для двухатомных гомоядерных (одного и того же элемента) молекул элементов второго периода. Число связывающих и разрыхляющих электронов зависит от их числа в атомах исходных элементов.
Следует отметить, что при образовании молекул N2 энергия связывающей 2рx-орбитали больше энергии связывающих 2ру– и 2рz-орбиталей, тогда как в молекулах О2 и F2, наоборот, энергия связывающих 2ру– и 2рz-орбиталей больше энергии связывающей 2рx-орбитали. Это нужно учитывать при изображении энергетических схем (см. рис. соответствующих молекул).

Рис.20. Энергетическая схема образования молекулярных орбиталей из атомных для гомоядерных молекул второго периода
Порядок связи в молекуле определяется разностью между числом связывающих и разрыхляющих электронов, деленной на два. Порядок связи может быть равен нулю (молекула не существует), целому или дробному положительному числу.
Подобно электронным формулам, показывающим распределение электронов в атоме по атомным орбиталям, в методе МО составляют формулы молекул, отражающие их электронную конфигурацию. По аналогии с атомными s-, p-, d-, f-орбиталями молекулярные орбитали обозначаются греческими буквами . Так, электронная конфигурация молекулы O2 записывается следующим образом:
Буквами КК показано, что четыре 1s-электрона (два связывающих и два разрыхляющих) практически не оказывают влияния на химическую связь.
Коммуникативный педагогический тренинг: способы взаимодействия с разными категориями учащихся
Сертификат и скидка на обучение каждому участнику

Научить школьников записывать схемы образования ковалентной связи для двухатомных молекул.
Сформировать понятие о кратности ковалентной связи.
Разъяснить смысл электронных и структурных формул.
Тип урока: Формирование новых знаний
Вид урока: Мультимедиа урок.
Оборудование: компьютер, проектор, мультимедийные ресурсы, периодическая система химических элементов Д.И.Менделеева.
I. Организационный момент
II.Актуализация знаний
Прежде чем рассматривать механизм ковалентной связи, учитель предлагает повторить с учащимися строение атома и распределение электронов по энергетическим уровням; объяснить на основании строения атома причину химической инертности атомов благородных газов; рассмотреть, что такое завершенный электронный слой. ( Презентация 1 )
Несколько учащихся на макете составляют электронные формулы ( Презентация 4 )
III. Изучение нового материала
Основными объектами окружающего нас мира являются атомы и молекулы. Наверняка многие из вас знают, что из атомов и молекул состоят все вещи в мире. Тогда как вы объясните, чем они отличаются? Если бы все атомы были одинаковыми, в мире существовал бы лишь один вид материи.
Вам известно, что в настоящее время, существует более ста разновидностей атомов, которые могут соединяться между собой. Если соединяются несколько атомов одного вида, они образуют простые вещества. Существуют и такие вещества, молекулы которых состоят из двух-трех и более атомов разного вида – их называют сложными. Каждое вещество имеет свое название и обладает уникальными свойствами. Каким же образом атомы соединяются между собой?
Далее обсуждаем, все ли атомы химических элементов соединяются. Нет ли в природе одиночных атомов? Оказывается, есть – это атомы благородных газов.
Электроны в атоме располагаются на энергетических уровнях. Электроны наружного слоя называют валентными. Полностью заполненным энергетическим уровнем обладают элементы VIII А группы – благородные (инертные) газы.
Сравниваем электронное строение атомов благородных газов, выясняем особенность завершенных и устойчивых внешних энергетических уровней:
Чем объяснить устойчивость внешнего восьмиэлектронного уровня? Причина этого заключается в том, что все электроны на внешних энергетических уровнях элементов спарены, то есть уже в атомах связаны попарно.
Поскольку электронная конфигурация благородного газа очень устойчива, то её стремятся достичь и атомы других элементов. Все атомы, объединяясь в молекулы, сделать это могут либо, отдав электроны, либо приняв электроны, либо обобществив свои электроны с электронами других атомов.
Число электронов, необходимых атомам разных химических элементов до завершения внешнего электронного слоя, различно.
Внешние электронные слои атомов других химических элементов могут содержать как спаренные, так и не спаренные электроны.
Предлагаем учащимся подсчитать, сколько электронов не хватает атомам каждого из химических элементов второго периода для завершения внешнего электронного слоя.
Вывод: если в атоме нет непарных электронов и нет возможности для их распаривания, как у инертных газов, они не образуют химической связи и соединений не образуют, потому и инертны. В образовании химической связи участвуют в основном непарные электроны наружного слоя атома. Сущность образования химической связи состоит в спаривании непарных электронов.
Ребята, мы ответили на один вопрос, поставленный в задачу нынешнего урока.
– Что заставляет атомы соединяться друг с другом в молекулы?
А вот как происходит это спаривание, нам предстоит разобраться.
Интересно, например, как осуществляется связь между атомами элементов-неметаллов, которые имеют сходную тенденцию к присоединению электронов? Рассмотрим вначале, как образуется связь между атомами одного и того же химического элемента, например в веществах, имеющих двухатомные молекулы.
Два одинаковых атома элемента-неметалла могут объединяться в молекулу только одним способом: обобществив свои внешние электроны, то есть, сделав их общими для обоих атомов.
Когда атомы обобществляют свои электроны, образуется ковалентная связь.
Ковалентная связь – это химическая связь, возникающая в результате образования общей электронной пары между взаимодействующими атомами.
Для наглядности изображения того как образуется ковалентная связь используются электронные формулы. В ней каждый атом обозначается буквенными символами соответствующего элемента, а вокруг этого символа точками обозначают все валентные электроны, в том числе и не участвующие в образовании связи. Одна точка обозначает один электрон.
Например: электронная формула водорода
электронная формула хлора
электронная формула кислорода
электронная формула азота
Для образования связи каждый атом предоставляет в общее пользование по одному электрону. Ковалентную связь образует только пара электронов, находящаяся между атомами. Она называется поделенной парой . Остальные пары электронов называют неподеленными парами . Они заполняют оболочки и не принимают участие в связывании. При этом образующаяся пара электронов принадлежит одновременно двум атомам.
Механизм возникновения ковалентной связи рассмотрим на примере образования молекулы водорода:
Ядро атома водорода окружено сферическим электронным облаком, образованным 1 s-электроном. При сближении атомов до определенного расстояния начинают действовать силы притяжения между ядром одного атома и электроном другого атома, а так же силы отталкивания между ядрами и между электронами
Ковалентная связь бывает двух видов – ковалентная неполярная и ковалентная полярная . Связано такое деление с тем, где именно между ядрами будут располагаться общие электронные пары – ровно посередине или будут смещены в сторону одного из ядер.
Расположение общих электронных пар между ядрами связывающихся атомов зависит от электроотрицательности атома.
Электроотрицательность – это способность атомов химического элемента оттягивать к себе общие электронные пары, участвующие в образовании химической связи.
У элементов рассчитали значение электроотрицательности и расположили их по возрастанию этого значения в ряд электроотрицательности (приводится не полностью):
Используя периодическую систему химических элементов Д.И. Менделеева, объясняем, что в периодах, слева направо, электроотрицательность увеличивается, в главных подгруппах сверху вниз – уменьшается. Что касается ряда то, правее стоящий в этом ряду элемент обладает большей электроотрицательностью и лучше оттягивает в свою сторону общие электронные пары. Фтор самый электроотрицательный элемент.
Если молекула состоит из атомов одного вида, электроотрицательность которых равна, то общие электронные пары будут находиться посередине между ядрами двух связывающихся атомов, поскольку ядра притягивают общие электронные пары в равной степени. В этом случае между атомами образуется ковалентная неполярная связь . Ковалентная неполярная связь образуется в таких молекулах как Н 2 , F 2 , N 2 и т.д.
Пример образования ковалентной неполярной связи вмолекуле фтора.
Рассмотрим образование ковалентной связи в молекуле фтора F 2 .
Электронная формула внешнего слоя атома фтора: 1s 2 2s 2 2p 5 , электронно-графическая формула:
Один из р-электронов в атоме фтора является неспаренным.
При образовании молекулы неспаренные электроны двух атомов фтора образуют одну общую электронную пару; в результате каждый атом фтора приобретает электронную структуру 2s 2 2p 6 , т.е. на внешнем энергетическом уровне помещается по восемь электронов.
Демонстрация схемы образования ковалентной неполярной химической связи в молекуле фтора. ( Презентация 3 , слайд 2)
Связь между атомами может быть образована и несколькими электронными парами. Существуют молекулы, в которых между двумя атомами возникают две или три общие электронные пары. Такие ковалентные связи называются двойными и тройными, а общее их название – кратные связи. При увеличении числа общих электронных пар прочность ее увеличивается.
Например, в молекулах водорода H 2 и фтора F 2 связь между атомами водорода и фтора соответственно – одинарная (однократная), в молекуле кислорода O 2 – двойная, а в молекуле азота N 2 – тройная. ( Презентация 3 , слайды 3, 4)
Подводим учащихся к выводу о том, что кратность связи в молекуле определяется (в основном) числом непарных электронов.
При соединении атомов одного элемента никакого смещения электронов не происходит, т.к. их электроотрицательность одинакова.
Если ковалентная связь образуется между атомами с различной ЭО, то общая электронная пара смещается в сторону атома с большей ЭО.
Схематично образование ковалентной полярной связи в молекуле НF можно изобразить так:
Молекула фтороводорода образована элементами, отличающимися по своей ЭО.
D Э.О. = 3,98 – 2,20 = 1,78
Общая электронная пара оказывается смещенной в сторону фтора, в результате на атоме фтора возникает частичный отрицательный заряд d – (дельта минус), а на атоме водорода – частичный положительный d + (дельта плюс) Н d + F d – . Таким образом, молекула становится полярной. Чем больше различается электроотрицательность взаимодействующих атомов, тем больше смещена общая электронная пара к наиболее электроотрицательному атому, тем полярнее химическая связь между атомами. ( Презентация 3 , слайд 5)
Направление смещения электронов обозначается также стрелкой: C ––> Cl, C ––> О, C ––> N, О
Ковалентная химическая связь между атомами разных элементов, при которой общая электронная пара (пары) смещена в сторону более ЭО элемента (разность ЭО ковалентной полярной .
Молекулы хлороводорода, воды, аммиака также являются полярными. Их еще называют диполями (имеющими два полюса).
Общую пару электронов иногда обозначают черточкой, которая символизирует химическую связь. Если общие электронные пары обозначать чертой, то электронная формула превращается в структурную:
H : Cl H–Cl
Электронные и структурные формулы показывают последовательность соединения атомов в молекуле. Например, в молекуле аммиака атомы водорода соединяются с атомами азота, но между собой не соединяются.
Под числом химических связей подразумевают число общих пар электронов. В структурной формуле соединения, число черточек, отходящих от данного атома, равно его валентности.
IV. Закрепление
Составление схемы образования ковалентной полярной связи в молекуле Н 2 O. ( Презентация 3 , слайд 6)
Выполнение тренировочного теста по теме. ( Презентация 2 )
V. Домашнее задание
§ 40, § 41, с 141 – 144. Составить схемы образования ковалентной связи в молекулах Сl 2 и HCl.

Читайте также:
 webdonsk.ru
webdonsk.ru