Как сделать кислоту из щелочи
Добавил пользователь Дмитрий К. Обновлено: 10.09.2024
Кислоты — класс сложных химических веществ, состоящих из атомов водорода и кислотных остатков.
В первую очередь кислоты делятся на:
- органические или карбоновые и
- неорганические или минеральные.
Свойства карбоновых кислот подробно разбираются в статье Карбоновые кислоты (ссылка на статью)
В зависимости от количества атомов водорода, которые могут замещаться в химических реакциях различают:
- одноосновные кислоты
- двухосновные кислоты
- трехосновные кислоты.
Не смотря на то, что в уксусной кислоте четыре атома водорода, три из них принадлежат кислотному остатку и в реакциях замещения не участвуют. Соответственно, уксусная кислота — одновалентная.
Свойства неорганических кислот также зависят от наличия в их составе кислорода и делятся на
Растворы кислот способны диссоциировать и проводить электрический ток т.е. являются электролитами. В зависимости от степени диссоциации делятся на:

Учебник написан преподавателями химического факультета МГУ им. М. В. Ломоносова. Отличительными особенностями книги являются простота и наглядность изложения материала, высокий научный уровень, большое количество иллюстраций, экспериментов и занимательных опытов, что позволяет использовать её в классах и школах с углублённым изучением естественно-научных предметов.
Химические свойства кислот
1. Диссоциация
При диссоциации кислот образуются катионы водорода и анионы кислотного остатка.
Многоосновные кислоты диссоциируют ступенчато.
НРО 2- 4 <-> Н + + PО З- 4 (третья ступень)
2. Разложение
Кислородсодержащие кислоты разлагаются на оксиды и воду.
Бескислородные на простые вещества
| t | ||
| 2HCl | -> | Cl2 + H2. |
3. Реакция с металлами
Кислоты реагируют лишь с теми металлами, что стоят в ряду активности до кислорода. В результате взаимодействия образуется соль и выделяется водород.
Из всех правил есть исключения.
Поскольку в состав азотной кислоты входит азот со степенью окисления +5, а в состав серной — сера со степенью окисления +6, то с металлами реагируют не ионы водорода, а более сильные окислители. Образуется соль, но не происходит выделения водорода.
4. Реакции с основаниями
В результате образуются соль и вода, происходит выделение тепла.
Реакции такого типа называются реакциями нейтрализации. Простейшая реакция, которую можно провести на собственной кухне — гашение соды столовым уксусом или 9%раствором уксусной кислоты.
5. Реакции кислот с солями
Вспомним, когда мы разбирали ионные уравнения ( ссылка на статью), одним из условий протекания реакций было образование в ходе взаимодействия нерастворимой соли, выделение летучего газа или слабо диссоциирующего вещества — например, воды. Те же условия сохраняются и для реакций кислот с солями.
6. Реакция кислот с основными и амфотерными оксидами
В ходе реакции образуется соль и происходит выделение воды.
7. Восстановительные свойства бескислородных кислот
Если в окислительных реакциях первую скрипку играет водород, то в восстановительных реакциях основная роль принадлежит анионному остатку. В результате реакций образуются свободные галогены.
Физические свойства кислот
При нормальных условиях (Атмосферное давление = 760 мм рт. ст. Температура воздуха 273,15 K = 0°C) кислоты чаще жидкости, хотя встречаются и твердые вещества: например ортофосфорная H3PO4 или кремниевая H2SiO3.
Некоторые кислоты представляют собой растворы газов в воде: фтороводородная-HF, соляная-HCl, бромоводородная-HBr.
Кислотные свойства кислот в ряду HF -> HCl -> HBr -> HI усиливаются.
Для некоторых кислот (соляная, серная, уксусная) характерен специфический запах.
Благодаря наличию ионов водорода в составе, кислоты обладают характерным кислым вкусом.
Химическая лаборатория не ресторан, и в целях безопасности существует жесткий запрет на опробование на вкус химических веществ.
Как же можно определить кислота в пробирке или нет?
В 1300 году был открыт лакмус, и с тех пор алхимикам и химикам не пришлось рисковать своим здоровьем, пробуя на вкус содержимое пробирок. Запомните, что лакмус в кислой среде краснеет.
Вторым широко используемым индикатором является фенолфталеин.
Простой мнемонический стишок поможет запомнить, как ведут себя индикаторы в разных средах.
Индикатор лакмус — красный
Кислоту укажет ясно.
Индикатор лакмус — синий,
Щёлочь здесь — не будь разиней,
Когда ж нейтральная среда,
Он фиолетовый всегда.
Фенолфталеиновый — в щелочах малиновый
Но несмотря на это в кислотах он без цвета.
ВНИМАНИЕ! Перед тем как приступить самостоятельному изготовлению щелочного электролита - ПОДУМАЙ! НУЖНО ЛИ ТЕБЕ ЭТО?! СДЕЛАЙ ПРОЩЕ - купи в нашем магазине готовый сухой калиево-литиевый щелочной электролит для аккумуляторов и просто добавь в него воды. Мы отправим его почтой, и вы быстро решите свою проблему.
- налить в посуду(термостойкую) необходимое количество воды;
- при помощи стальных щипцов или лопатки опустить в воду небольшими порциями кусочки щелочи;
- для ускорения прохождения реакции растворения щелочи в воде, раствор необходимо перемешивать пластмассовой, эбонитовой, стальной или стеклянной мешалкой;
- откорректировать плотность электролита, добавив необходимое количество воды или щелочи;
- изолировав посуду с электролитом от доступа воздуха и дать ему остыть и отстояться в течение 3-6 часов до полного осветления;
- осторожно слить осветленную часть электролита. Получаемые для заливки аккумуляторов щелочные растворы представляют собой прозрачные, слегка желтоватые жидкости, без запаха. На дне раствора допускается наличие небольшого количества темного осадка.
- АККУМУЛЯТОРЫ И БАТАРЕИ НИКЕЛЬ-КАДМИЕВЫЕ KCSL (Техническое описание и инструкция по эксплуатации)
- ИНСТРУКЦИЯ ПО ПРИГОТОВЛЕНИЮ ЩЕЛОЧНОГО ЭЛЕКТРОЛИТА (Выдержки из тех.описания) - 1лист, 2лист.
- ОСЛУЖИВАНИЕ ШАХТЕРСКОГО ФОНАРЯ (Зарядка аккумулятора 3ШНКП-10М.05, специфика работы)
Плотность щелочного электролита.
- Температура: -15…+35 °С (допустимы кратковременные повышения температуры электролита до 45 °С.) Состав: КОН +LiOH Плотность: 1,19 –1,21 г/см3 +20 г/л (LiOH)
- Температура: -25…-15 °С Состав: КОН Плотность: 1,25 г/см3
- Температура: -40…-25 °С Состав: КОН Плотность: 1,27 г/см3
- Температура: >=+40…+60 °С Состав: NaОН +LiOH Плотность: 1,17 –1,19 г/см3 +от 10 до 15 г/л (LiOH) Заряд необходимо проводить током 0,25С в течении 8 часов.
- Температура: +10…+60 °С Состав: NaОН Плотность: 1,17 –1,19 г/см3
- Температура: -15…+15 °С Состав: КОН Плотность: 1,19 –1,21 г/см3
- Температура: +10…+30 °С Состав: NaОН Плотность: 1,17 –1,19 г/см3
- при проверке состояния заряда необходимо делать замеры в нескольких ячейках батареи;
- не ожидайте точного считывания показаний ареометра(А) сразу после залива электролита в аккумулятор (В), смотрите рисунок;
- температура батареи влияет на точность считывания. Электролит должен быть при нормальной комнатной температуре;
- соблюдайте правила техники безопасности при работе с едкими веществами;
- электролит, который остается в ареометре, является коррозионным веществом. Не забывайте его промывать после использования.
- При переходе с летнего режима на зимний и наоборот;
- В случае неисправности;
- Для удаления скапливающихся вредных примесей (карбонатов) ухудшающих работу аккумуляторов.
- Концентрация LiOH: 5 г/л, увеличение ёмкости: 10%
- Концентрация LiOH: 20 г/л, увеличение ёмкости: 18%
- Концентрация LiOH: 50 г/л, увеличение ёмкости: 22%.
Купить щелочной электролит можно у нас

Купить щелочной калиево-литиевый электролит плотностью 1,41г\см3 (жидкий) в Новосибирске можно в нашем магазине, в разделе "Сырье, химреактивы/Щелочь KOH". Плотность щелочного электролита измеряется прибором Ареометр купить , который вы тоже можете в нашем магазине.
Таблица 1. – Основания и амфотерные гидроксиды
Это НЕ основания:
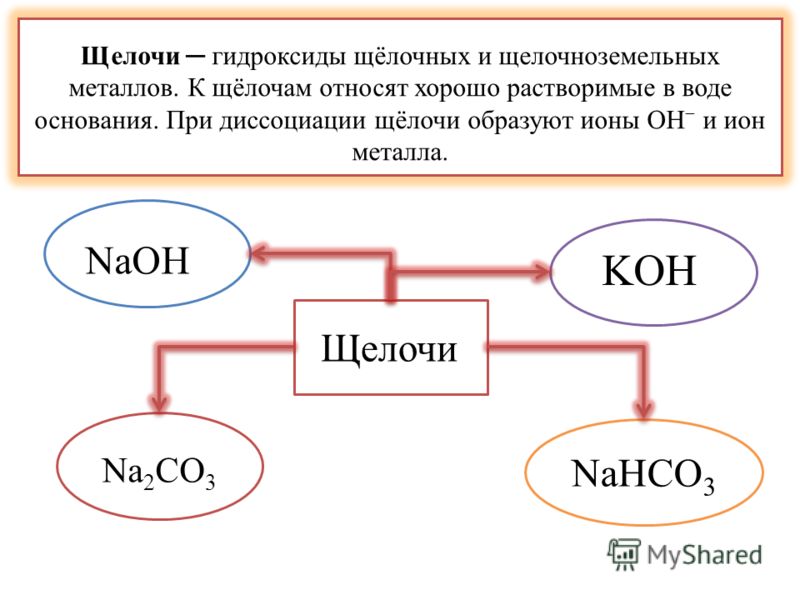
Чем отличаются щёлочи от остальных оснований?
Основания можно разделить на две группы: растворимые и нерастворимые. Растворимые иначе называют щелочами. То есть щелочи – это растворимые основания (растворимые основные гидроксиды).
Таблица 2. – Основания и щёлочи
Место щелочей в классификации гидроксидов
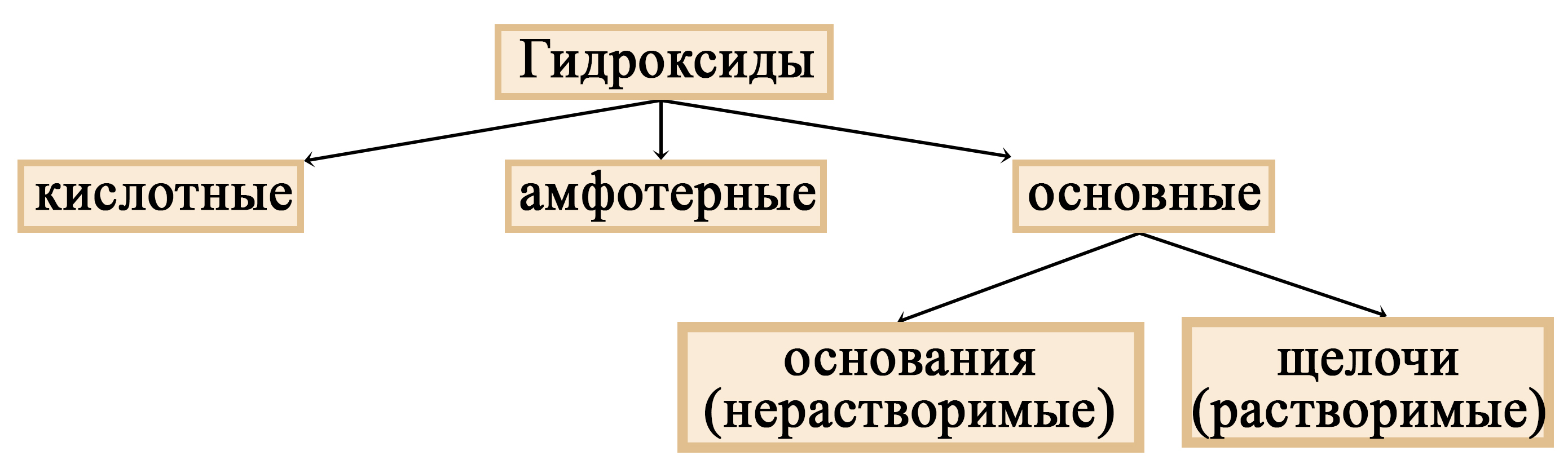
Щелочи – растворимые основания
Как определить, является ли основание растворимым, то есть щелочью, если его нет в таблице растворимости?
В состав щелочей входят металлы IА-группы Периодической Системы Д. И. Менделеева, а также кальций, стронций и барий.
Полный список щелочей:
NaOH – гидроксид натрия, едкий натр, гидроокись натрия, каустическая сода
KOH – гидроксид натрия, едкое кали, гидроокись калия
LiOH – гидроксид лития, гидроокись лития
CsOH – гидроксид цезия, гидроокись цезия
FrOH – гидроксид франция, гидроокись франция
RbOH – гидроксид рубидия, гидроокись рубидия
Ba(OH)2 – гидроксид бария, едкий барий, баритовая вода
Ca(OH)2 – гидроксид кальция, гашеная известь, известковое молоко, известковая вода.
Sr(OH)2 – гидроксид стронция
Остальные основания считаем нерастворимыми (кроме аммиака, образующего гидрат аммония, являющегося хоть и растворимым, но нестойким соединением). Гидроксид аммония, образующийся при пропускании аммиака через воду, можно представить в виде формулы NH4OH (лучше NH3;H2O – гидрат аммония) является растворимым (раствор называют нашатырным спиртом), однако щелочью это вещество не является.
Гидроксид лития и гидроксид кальция растворяются не так хорошо, как другие основания, но все равно считаются щелочами.
Задание в формате ЕГЭ с ответом:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Комментарий к заданию: Галлий, в представленном гидроксиде, имеет степень окисления +3, поэтому он относится к группе амфотерных гидроксидов. Гидроксид рубидия – щелочь, так как рубидий – элемент IА-группы. Гидроксид хрома – нерастворимое основание, так как хром в степени окисления +2 не является амфотерным, и не относится к щелочным или щелочноземельным металлам, поэтому не может образовать щелочь.
Пример задания из КИМ ЕГЭ:
Установите соответствие между формулой вещества и классом/группой, к которому(-ой) это вещество принадлежит: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
- щелочь
- нерастворимое основание
- амфотерный гидроксид
Комментарий к заданию: Стронций является щелочноземельным металлом (металлы IIА-группы, кроме магния и бериллия, образуют растворимые гидроксиды), поэтому образует щелочь. Гидроксид цинка вместе с гидроксидом бериллия входят в группу исключений и, несмотря на вторую валентность, образуют амфотерные гидроксиды. Гидроксид железа нерастворим и не входит в группу амфотерных веществ, он является нерастворимым основанием.
Щёлочи, являясь сильными основаниями, диссоциируют в воде очень быстро, тогда как нерастворимые основания диссоциируют медленно, ступенчато:
Диссоциация щелочей
Диссоциация слабых оснований
Fe(OH)2 = FeOH + + OH - (I ступень)
FeOH + = Fe 2+ + OH - (II ступень)
Диссоциация настолько быстрая, что ступенчатостью процесса можно пренебречь
Диссоциация очень медленная, быстрее идет по первой ступени, по второй ступени практически не идёт
Физические свойства щелочей
Гидроксиды щелочных металлов (металлов IА-группы) – твердые бесцветные кристаллические вещества. Как уже было описано выше, большинство из них очень хорошо растворимы в воде. Гидроксиды щелочноземельных металлов хуже растворяются в воде.
Химические свойства щелочей
Основные свойства гидроксидов в Периодической системе возрастают справа налево и сверху вниз. Поэтому все щелочи, образованные металлами IА-группы сильнее щелочей, образованных металлами IIА-группы.
Щелочи окрашивают фенолфталеин в малиновый цвет.
Твёрдые щелочи и их концентрированные растворы разъедают живые ткани, поэтому работать с ними нужно в перчатках, а при растирании твёрдой щелочи в ступке необходимо надевать очки.
- Щелочи реагируют с кислотными оксидами, образуя либо соль и воду, либо кислую соль:
Щелочь + кислотный оксид = соль + вода
Щелочь + кислотный оксид = кислая соль
Рассмотрим эти реакции на примере образования карбонатов и гидрокарбонатов.

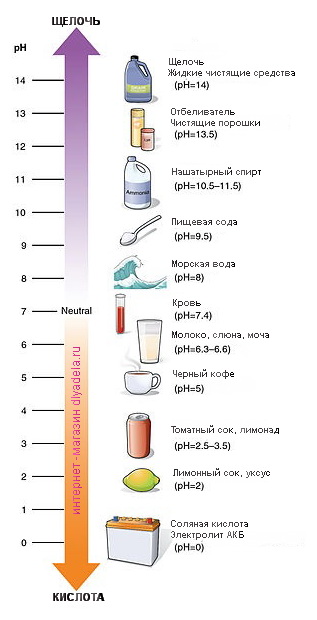
Кислоты и щёлочи отличают по показателям pH (шкала pH). Ниже Вы видите картинку – это специальная шкала, на которой имеются числа от 0 и до 14. Нулём обозначают самые сильные кислоты, а четырнадцатью – самую сильную щёлочь. Но какая же середина между этими числами? Может быть 5, может быть 7, а может быть 10? Серединой принято считать число 7 (нейтральное положение). То есть числа до 7 это все кислоты, а больше 7 это щёлочи.
Именно для этой шкалы разработаны специальные индикаторы — лакмусы. Это обычная полоска, которая реагирует на среду. В кислотной среде она окрашивается в красный цвет, а в щелочной среде – в синий цвет. Она необходима не только в химии, но и в быту.
Например, если у Вас есть аквариум, то немаловажную роль играет кислотность воды. От неё зависит вся жизнь аквариума. К примеру, показатель кислотности воды для аквариумных рыбок колеблется от 5 до 9 рН. Если будет больше или меньше, то рыбка будет чувствовать себя не комфортно, а может и вовсе умереть. Всё тоже самое и с растениями для аквариумов…
Кислоты
Такие кислоты, как лимонная или уксусная, т.е. произведенные живыми организмами, называются органическими. Кислоты широко применяются в химической и медицинской промышленности, в производстве продуктов питания и синтетических волокон. Виноградный уксус содержит слабую кислоту, называемую уксусной. В помидорах есть органическая салициловая кислота. В цветных пятнах на коже морских улиток содержится кислота с неприятным вкусом, отпугивающая хищников. Для всех кислот характерно сходное поведение в химических реакциях. Например, при реакциях кислот с основаниями образуется нейтральное соединение — соль и вода. Реакции кислот с большинством металлов дают соль и водород. Реагируя с карбонатами, кислоты дают соль, углекислый газ и воду. Известный кулинарам пекарный порошок содержит гидрокарбонат натрия и винную кислоту. Когда в муку, содержащую пекарный порошок, добавляют воду, кислота и карбонат порошка вступают в реакцию, углекислый газ начинает выделятся в виде пузырьков, и это помогает тесту подниматься.
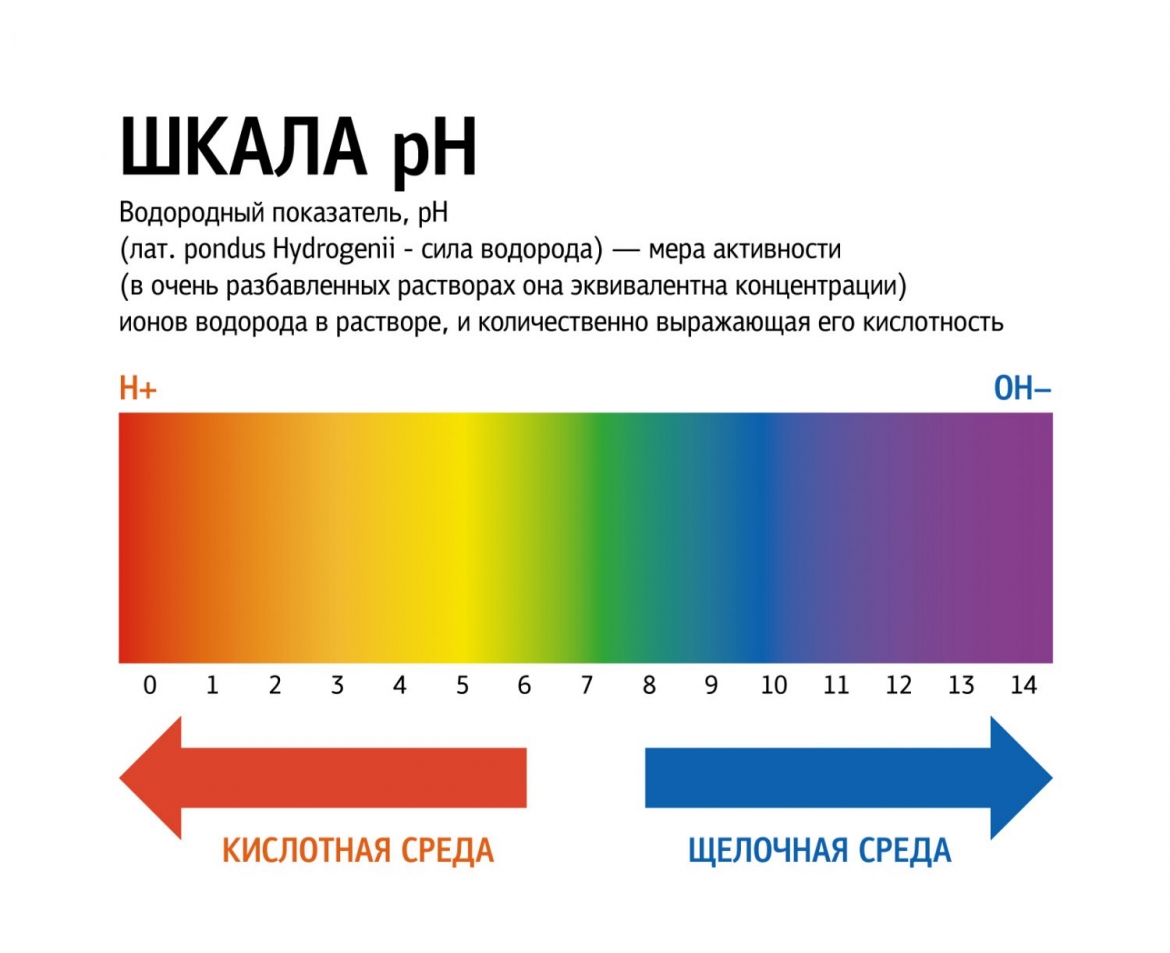
рН и индикаторы
Сила кислот и оснований определяется числом рН. Это мера концентрации ионов водорода в растворе. Число рН изменяется от 0 до 14. Чем меньше рН, тем выше концентрация водородных ионов. Раствор, рН которого меньше 7, — кислота. Апельсиновый сок имеет рН 4, значит, это кислота. Вещества с рН = 7 нейтральны, а вещества с рН больше 7 — основания или щелочи. рН кислоты или щелочи можно определить с помощью индикатора. Индикатор — это вещество, меняющее цвет при контакте с кислотой или щелочью. Так лакмус краснеет в кислоте и синеет в щелочи. Кислота окрашивает синюю лакмусовую бумажку в красные цвет, а красная лакмусовая бумажка в щелочи становится синей или фиолетовой. Лакмус получают из примитивных растений, называемых лишайниками. Другие растения, например, гортензия и краснокочанная капуста, также являются природными индикаторами.

Так называемый универсальный индикатор – это смесь нескольких красок. Он меняет цвет в зависимости от pH вещества. Он становится красным, оранжевым или желтым в кислотах, зеленым или желтым в нейтральных растворах и синим или фиолетовым в щелочах.
Серная кислота
Серная кислота играет важную роль в промышленности, прежде всего в производстве удобрений на основе суперфосфатов и сульфата аммония. Она также используется в производстве синтетических волокон, красителей, пластмасс, лекарств, взрывчатых веществ, моющих средств, автомобильных аккумуляторов. Когда-то серную кислоту называли минеральной кислотой, так как ее получали из серы — вещества, встречающегося в земной коре в виде минерала. Серная кислота очень активна и агрессивна. При растворении в воде она выделяет много тепла, поэтому ее нужно вливать в воду, но не наоборот — тогда кислота растворится, а вода поглотит тепло. Она — мощный окислитель, т.е. при реакциях окисления она отдает кислород другим веществам. Серная кислота также является осушителем, т.е. забирает воду, связанную с другим веществом. Когда сахар (C12H22O11) растворяется в концентрированной серной кислоте, кислота забирает у сахара воду, и от сахара остается пенящаяся масса черного угля.
Кислоты в почве
Цветы гортензии на кислотной почве синие, а на щелочной — розовыеКислотность почвы зависит от характера образовавших ее пород и от растущих на ней растений. На меловых и известняковых породах почва обычно щелочная, а на лугах, в песчаных и лесистых районах она более кислая. Кислотность также повышают кислотные дожди. Для земледелия лучше всего подходят нейтральные или слабокислые почвы, рН которых от 6,5 до 7. Разлагаясь, мертвые листья образуют органическую гуминовую кислоту и повышают кислотность почвы. Там, где почвы чересчур кислотные, в них добавляют измельченный известняк или гашеную известь (гидроксид кальция), т.е. основания, которые нейтрализуют кислоты почвы. Такие растения, как рододендроны и азалии хорошо растут на кислотных почвах. Цветы гортензии на кислотной почве синие, а на щелочной — розовые. Гортензия – природный индикатор. На кислотных почвах её цветы синие, а на щелочных розовые.
В настоящее время в химии принята теория Брёнстеда — Лоури и Льюиса, которая определяет кислоты и основания. В соответствии с этой теорией, кислоты — это вещества, способные отщеплять протон, а основания — отдавать электронную пару OH-. Можно сказать, что под основаниями понимают соединения, которые при диссоциации в воде образуют только анионы вида OH-. Если совсем просто, то щелочами называют соединения, состоящие из металла и гидроксид-иона OH-.
Свойства щелочей
Щелочи — твердые вещества белого цвета; гигроскопичные, водорастворимые. Растворение в воде сопровождается активным выделением тепла. Вступают в реакции с кислотами, образуя соль и воду. Эта реакция нейтрализации является важнейшей из всех свойств щелочей. Кроме этого, гидроксиды реагируют с кислотными оксидами (образующими кислородосодержащие кислоты), с переходными металлами и их оксидами, с растворами солей.
Гидроксиды щелочных металлов растворяются в метиловом и этиловом спиртах, способны выдерживать температуры до +1000 °С (за исключением гидроксида лития).
Гидроксид натрия (едкий натр) используется в чистящих жидкостях, а также (как и гидроксид калия) для производства мыла. Мыло — это соль, образующаяся при реакции щелочей с кислотами растительных жиров. Жало осы выпускает щелочь, которую можно нейтрализовать кислотой, например уксусом.
Щелочи — активные химические реагенты, поглощающие из воздуха не только водяные пары, но и молекулы углекислого и сернистого газа, сероводорода, диоксида азота. Поэтому хранить гидроксиды следует в герметичной таре или, например, доступ воздуха в сосуд со щелочью организовать через хлоркальциевую трубку. В противном случае хим.реактив после хранения на воздухе будет загрязнен карбонатами, сульфатами, сульфидами, нитратами и нитритами.
Если сравнивать щелочи по химической активности, то она увеличивается при движении по столбцу таблицы Менделеева сверху вниз.
Концентрированные щелочи разрушают стекло, а расплавы щелочей — даже фарфор и платину, поэтому растворы щелочей не рекомендуется хранить в сосудах с пришлифованными стеклянными пробками и кранами, так как пробки и краны может заклинить. Хранят щелочи, обычно, в полиэтиленовых емкостях.
Именно щелочи, а не кислоты, вызывают более сильные ожоги, так как их сложнее смыть с кожи и они проникают глубоко в ткань. Смывать щелочь надо неконцентрированным раствором уксусной кислоты. Работать с ними необходимо в средствах защиты. Щелочной ожог требует немедленного обращения к врачу!
Применение щелочей
— В качестве электролитов.
— Для производства удобрений.
— В медицине, химических, косметических производствах.
— В рыбоводстве для стерилизации прудов.
Едкий натр. Самая популярная и востребованная в мире щелочь. Применяется для омыления жиров в производстве косметических и моющих средств, для изготовления масел в процессе нефтепереработки, в качестве катализатора и реактива в химических реакциях; в пищепроме.
Едкое кали. Применяется для производства мыла, калийных удобрений, электролитов для батареек и аккумуляторов, синтетического каучука. Также — в качестве пищевой добавки; для профессиональной очистки изделий из нержавеющей стали.
Гидроксид алюминия. Востребован в медицине как отличный адсорбент, антацид, обволакивающее средство; ингредиент вакцин в фармацевтике. Кроме этого, вещество применяется в очистных сооружениях и в процессах получения чистого алюминия.
Гидроокись лития. Востребованное соединение в химпроме как сырье; в стекольной, керамической, Фиксаналырадиотехнической индустрии; для производства смазочных материалов, электролитов; для поглощения вредных газов.
Гидроокись бария. Применяется в химпроме как катализатор, а также в пищепроме для очистки жиров, сахара.
Есть мнения что:
• Кислоты и щелочи неспособны мирно сосуществовать даже одну секунду, находясь в соприкосновении. Перемешавшись, они мгновенно начинают бурное взаимодействие. Химическая реакция с ними сопровождается шипением и разогревом и длится до тех пор, пока эти ярые антагонисты не уничтожат друг друга.
• Кислотам свойственно образовывать кислую среду, а щелочам – щелочную.
• Химики отличают щелочь от кислоты по ее поведению с лакмусовой бумажкой или фенолфталеином.
Приблизительные растворы. Наиболее употребительными растворами щелочей в лабораторной практике являются растворы едкого натра NaOH. Растворы едкого кали KOH готовят редко, растворы же аммиака почти всегда покупают готовыми.
Технический едкий натр продают отлитым в железные бочки, чистый — пластинчатыми кусками, а химически чистый —в виде палочек или таблеток.
При растворении щелочи происходит сильное разогревание, в особенности в тех местах, где лежат куски ее. Чтобы растворение шло быстрее, раствор следует все время перемешивать стеклянной палочкой.
Применять стеклянную посуду при растворении щелочи не рекомендуется, потому что она может легко разбиться и работающий может пострадать, так как концентрированный раствор щелочи разъедает кожу, обувь и одежду. Если приходится готовить малые количества щелочи, то можно растворять ее и в стеклянной посуде.
Куски щелочи голыми руками брать нельзя, их следует брать тигельными щипцами, специальным пинцетом или в крайнем случае руками, но обязательно в резиновых перчатках.
Вначале рекомендуется готовить концентрированные растворы щелочи плотности 1,35—1,45 г/см3, т. е. 32— 40%-ные. В подобных концентрированных растворах
* В технике едкий натр часто называют каустической содой.
щелочи многие примеси не растворяются и при отстаивании раствора оседают на дно. Отстаивание концентрированного раствора щелочи продолжается несколько дней (не меньше двух) *. Отстоявшийся раствор осторожно сливают, лучше всего сифоном, в другой сосуд, а осадок выбрасывают или употребляют для мытья посуды.
Если в лаборатории приходится часто и в больших количествах готовить растворы щелочи, то применяют следующий прием. Сначала полностью растворяют щелочь в фарфоровой чашке, и когда раствор немного остынет (до 40—50° С), его через воронку сливают в стеклянную бутыль подходящей емкости. Бутыль хорошо закрывают резиновой пробкой, снабженной отверстием, в которое вставляют хлоркальциевую трубку, наполненную натронной известью (для поглощения двуокиси углерода). Когда щелочь отстоится и на дне образуется резко отграниченный слой осадка (в 1—2 см от дна), верхний слой раствора сливают в другую бутыль. В резиновую пробку последней вставляют две трубки, одна из которых должна входить приблизительно на 1/3 высоты бутыли, а другая должна быть на 1—2 см ниже пробки (рис. 350).
На наружный конец длинной стеклянной трубки насаживают резиновую трубку со стеклянным концом, который опускают в бутыль с отстоявшейся щелочью. Нижний конец этой трубки следует изогнуть так, как показано на рис. 350. Такой конец препятствует захвату осадка со дна бутыли даже в том случае, если конец трубки коснется осадка. Короткую трубку соединяют с вакуум-насосом. Включив насос, отстоявшийся раствор быстро и безопасно перекачивают в другую бутыль. При Переливании щелочи нужно следить, чтобы трубка, опущенная в сосуд с отстоявшейся щелочью, не поднимала осадок со дна. Поэтому ее в начале переливания держат достаточно высоко над осадком, постепенно опуская к концу переливания.
После этого определяют ареометром плотность раствора и по таблице находят процентное содержание щелочи. Если нужно приготовить более разбавленный раствор, то разбавление проводят, применяя описанные выше способы расчета.
Для покрытия стенок бутыли парафином несколько кусков его помещают внутрь бутыли и последнюю нагревают в сушильном шкафу или же над электрической плитой или газовой горелкой (осторожно) до 60—8O0C Когда парафин расплавится, бутыль поворачивают и распределяют расплавленную массу тонким слоем по всей внутренней поверхности.
Парафиновый или церезиновый слой можно нанести, применяя раствор этих веществ в авиационном бензине. Парафин вначале растворяют в бензине, полученный раствор наливают в бутыль, которая должна быть покрыта внутри парафином. Стенки бутыли обмывают внесенным раствором парафина, медленно поворачивая ее "о оси в горизонтальном положении. Когда на стекле образуется парафиновая пленка, бутыль продувают воздухом до полного вытеснения паров бензина. Затем бутыль один-два раза споласкивают водой. Только после этого ее можно заполнять щелочью или другой жидкостью.
Обработка бутылей для хранения щелочей особенно важна для аналитических лабораторий, так как предотвращает загрязнение титрованных растворов продуктами выщелачивания стекла.
Точные растворы. Приготовление точных растворов отличается тем, что для них берут химически чистую щелочь, растворяют ее, как указано выше, и определяют содержание щелочи титрованием точным раствором кислоты.

Титр раствора щекочи (т. е. точную концентрацию раствора) лучше всего устанавливать по раствору щавелевой кислоты (C2H2O4 •2H2O)*.
Продажную щавелевую кислоту следует один-два раза перекристаллизовывать и только после этого применять для приготовления точного раствора. Это двухосновная кислота и,следовательно, ее эквивалентный вес равен половине молекулярного. Так как последний равен 126,0665, то эквивалентный вес ее будет:

Приготовляя 0,1 и. раствор NaOH, мы должны иметь раствор щавелевой кислоты такой же нормальности, для чего на 1 л раствора ее нужно взять:

Но для установки титра такое количество раствора не нужно; достаточно приготовить 100 мл или максимум 250 мл. Для этого на аналитических весах отвешивают около 0,63 г (для 100 мл) перекристаллизованной щавелевой кислоты с точностью до четвертого десятичного знака.
Начинающие работники при взятии навесок для установки титра часто стараются отвесить точно указанное в руководстве количество вещества (в нашем случае 0,6303 г). Этого делать ни в коем случае не надо,так как такое отвешивание неминуемо требует многократных от-
Зная массу взятого вещества и объем раствора, легко вычислить его точную концентрацию, которая в нашем случае будет равна не 0,1 н., а немного меньше. При таком способе несколько усложняется расчет, но достигается большая точность и значительная экономия времени.
Когда раствор будет готов, берут из него пипеткой 20 мл, переносят в коническую колбу, добавляют несколько капель фенолфталеина и титруют приготовленным раствором щелочи до появления слабого розового окрашивания.
Пример. На титрование израсходовано 22,05 мл раствора щелочи Вычислить его титр и нормальность.
Щавелевой кислоты было взято 0,6223 г вместо теоретически рассчитанного количества 0.6303 г. Следовательно, концентрация раствора ее не точно 0,1 н., а равна

Чтобы вычислить нормальность раствора щелочи, следует воспользоваться соотношением N[Vi = /V2-V2, т. е. произведение объема на нормальность известного раствора равно произведению объема на нормальность неизвестного раствора. В нашем случае известным является раствор щавелевой кислоты, следовательно

Нормальность раствора щелочи равна 0,08955.
Чтобы вычислить титр, или содержание NaOH в 1 мл раствора, следует нормальность умножить на грамм-эквивалент щелочи и полученное произведение разделить на 1000. Тогда титр раствора щелочи будет:

В тех случаях, когда требуются особо чистые растворы едкого натра, их готовят или из спиртовых растворов NaOH, или из амальгамы натрия.
Металлический натрий растворяют в максимально обезвоженном этиловом спирте. Спиртовый раствор готовят приблизительно 5%-ным. Небольшой стакан, наполненный до половины и не больше чем на 3U его объема чистым керосином или лигроином, тарируют на техно-химических весгГх дробью или гирьками. Из банки, в которой хранится металлический натрий под керосином или лигроином, берут пинцетом или ножом кусочки натрия и, обрезав наружные корки ножом, переносят в тарированный стакан, отвешивая нужное количество. При этой операции гири и тару ставят на левую чашку весов, а стакан с керосином — на правую чашку. *
Иногда вместо металлического натрия применяют металлический калий или растворяют в спирте гидроокись натрия или калия. Следует помнить, что растворимость при 28° С в этиловом спирте NaOH меньше, чем растворимость КОН, почти вдвое (соответственно 14,7 г/100 г и 27,9 г/100 г).
Спиртовые растворы щелочей обычно имеют слабожелтую окраску, вызываемую осмолепием при действии щелочи на примеси, особенно непредельных соединений, которые могут присутствовать в спирте.
Для приготовления бесцветных растворов КОН, не желтеющих и не темнеющих при употреблении и хранении, рекомендован следующий прием. Около 5 мл бу-тилата алюминия прибавляют при перемешивании к 1 л этилового спирта при температуре около 20° С. Этой смеси дают стоять несколько недель, но не меньше месяца, после чего спирт осторожно сливают (лучше всего с применением сифона для декантации) и добавляют к нему требуемое количество КОН. Бутилат алюминия вызывает выпадение в осадок всех примесей, от которых зависит пожелтение или даже потемнение спиртовых растворов щелочей.
Для получения раствора NaOH можно пользоваться также амальгамой натрия. Для ее приготовления отвешивают 2,5 г металлического натрия и 100 г ртути. Ртуть наливают в пробирку, последнюю помещают в стакан, поставленный в фарфоровую чашку. Предварительно заготавливают несколько стеклянных палочек с оттянутым концом (длина палочек 35—40 см). На палочку надевают кусок асбеста так, чтобы при опускании палочки пробирка закрывалась асбестом. При шэмощи этой палочки вынимают из керосина кусочек металлического натрия величиной с горошину, быстро вытирают его фильтровальной бумагой и вносят в ртуть. Следует учитывать, что при этом возможна легкая вспышка. Постепенно вносят в ртуть весь металлический натрий. Получаемая амальгама (раствор металла в ртути) должна быть жидкой, но она может постепенно затвердеть. Жидкую амальгаму выливают в сосуд с водой, предварительно освобожденной от двуокиси углерода. Сосуд следует снабдить отводной трубкой с клапаном Бунзена. Если амальгама затвердеет, пробирку нужно разбить и кусочки амальгамы поместить в воду, не содержащую двуокиси углерода. Через два дня раствор едкого натра сливают со ртути и устанавливают его нормальность, как описано выше.
О приготовлении растворов, титр которых устанавливают по определяемому веществу, см. выше.
Для приготовления точных растворов щелочей используют также ионообменный способ. Аниониты могут быть применены для очистки растворов едкого натра и едкого кали от карбонатов и для приготовления точных растворов едкого натра и едкого кали, исходя из точных навесок хлористого натрия или хлористого калия.
Если нужно отделить только карбонаты и не загрязнять раствор ионами хлора, первые порции раствора, прошедшего через колонку в Cl-форме, отбрасывают до тех пор, пока хлорид-ион не перестанет обнаруживаться в пробе раствора.
Насыщенный карбонат-ионами анионит можно снова перевести в С1-форму обычным приемом, т. е. пропуская через колонку с соляной кислотой, затем колонку хорошо промывают водой.
Для получения точного раствора' едкого натра или едкого кали рассчитанную навеску хлористого натрия или хлористого калия, отвешенную на аналитических весах, растворяют в дистиллированной или деминерализованной воде и полученный раствор пропускают через хро-матографическую колонку, наполненную анио-нитом в ОН-форме. Из колонки будет вытекать раствор щелочи рассчитанной концентрации.
Точные растворы NaOH или KOH лучше всего сохранять в полиэтиленовой посуде, на которую щелочи не действуют, или в стеклянной посуде парафинированной внутри.

Читайте также:
 webdonsk.ru
webdonsk.ru