Как сделать качественную реакцию
Добавил пользователь Алексей Ф. Обновлено: 08.09.2024
Растворы индикаторов (метилоранжа, лакмуса, фенолфталеина), растворы нитрата серебра, хлорида бария, сульфата натрия, серной кислоты, гидроксида натрия (калия). Набор реактивов должен быть рассчитан на пару учащихся, в наборе каждой парте стоят три пробирки с прозрачными растворами: серной кислоты (пробирка №1), гидроксида калия (пробирка №2) и хлорида бария (пробирка №3).
При возможности урок лучше сопровождать электронной презентацией.
Далее представлен урок, основанной на исследовательской работе.
1. Организационный момент (1-2 мин).
Учитель организует внимание учащихся.
2. Овладение содержанием учебного материала (20 мин).
А) Понятие качественных реакций.
На этом этапе урока учащийся, выполнявший исследовательскую работу, рассказывает о качественных реакциях и их видах.
Качественные реакции - характерные реакции, используемые для идентификации различных веществ.
Для определения присутствия веществ, анионов, катионов используются различные химические реакции. Эти реакции широко используются при проведении качественного анализа, целью которого является определение наличия веществ или ионов в растворах или смесях.
Качественные реакции можно разделить на два вида: качественные реакции на катионы и анионы.
Качественные реакции на катионы
Это реакции, с помощью которых можно определить наличие того или иного катиона в растворе. Основные качественные реакции на катионы представлены в таблице 1.
Качественные реакции на катионы.
Качественные реакции на катионы основаны на протекании химической реакции и на изменении цвета пламени, то есть на физическом процессе.
Определить наличие в растворе таких ионов как Li + , Na +, К + , Са 2+ , Sr 2+ с помощью химического взаимодействия невозможно, так как эти ионы не могут быть связаны в растворе с образованием нерастворимого вещества. Ионы, которые можно связать в растворе с образоваием осадка можно обнаружит с помощью химических реакций, так например ионы серебра дают белый осадок хлорида серебра с ионоами хлора: Аg + +Cl - =AgCl.
Некоторые ионы можно определить двумя способами и по химическому взаимодействию, и по цвету пламени. Например, ионы Ba 2+ окрашивают пламя в желто-зеленый цвет, но также ионы Ba 2+ вступают в реакцию с анионами SO4 2- с образованием сульфата бария: SO4 2- + Ba 2+ = BaSO4.
Таким образом определить наличие в растворе катионов можно как с помощью химических реакций, так по окраски пламени.
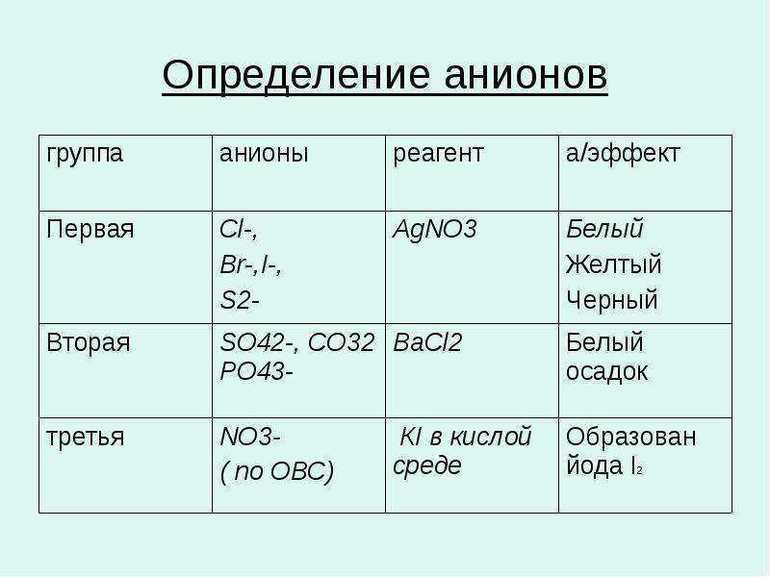
Это реакции, с помощью которых можно определить наличие того или иного аниона в растворе. Основные качественные реакции на анионы представлены в таблице 2.
Качественные реакции на катионы.
Качественные реакции на анионы основаны на химическом взаимодействии, то есть определить наличие того или иного иона можно, только проведя химическую реакцию. Например, что бы определить наличие в растворе ионов хлора, необходимо провести химическое взаимодействие изучаемого объекта с растворимой солью серебра, тогда сущность реакции будет отражаться следующим ионным уравнением:
В своей работе я буду использовать качественные реакции для изучения воды различного происхождения.
Таким образом, проведя качественные реакции можно подтвердить однозначно их наличие определенных ионов в растворе.
Б) Использование качественных реакций.
Данный этап урока посвящен тому, где можно использовать качественные реакции. Ученик, выполнявший исследовательскую работу рассказывает о практической части своей работы, где проводилось исследование различных образцов воды.
Экспериментальная часть работы состояла из двух опытов по изучению качественного состава образцов водопроводной и природной воды.
Цель: исследование состава воды (водопроводного и природного происхождения) с помощью качественных реакций (на ионы H + , OH - , Cl - , SO4 2- ).
а) Первый опыт (проведен 14.02.09):
Характеристика изучаемых образцов воды:
Водопроводная вода (Красное Село);
Водопроводная вода (территория гимназии);
Растаявший снег (около гимназии);
Фильтрованная, водопроводная вода из территории гимназии (фильтр "Аквафор").
Опыт проводился следующим образом: каждый образец воды был разделен на четыре части. К каждой части соответственно добавлялся соответствующий реактив, полученные наблюдения представлены в таблице, а ход опыта на рисунке. В случае определения проведения качественных реакций на кислоту и щелочь, по мимо изучаемых образцов использовались контрольные образцы, содержащие соответственно соляную кислоту и гидроксид калия. Это необходимо, для того чтобы лучше увидеть изменение цвета индикатора.
В первом опыте исследовались четыре образца воды (водопроводная вода и Красного Села; водопроводная вода с территории гимназии; растаявший снег, собранный около гимназии; фильтрованная вода), наблюдения представлены в таблице, откуда видно, что в исследуемых образцах нет кислоты, щелочей и сульфат ионов. Опыт показал, что в водопроводной воде из Красного Села содержится значительное количество хлорид ионов, а в водопроводной воде с территории гимназии содержание хлорид ионов не значителен. Вода, полученная при таянии снега, и фильтрованная вода не содержат хлорид ионов в обнаруживаемых количествах.
б) Второй опыт (проведен 21.02.08):
- Образец воды с магистрали
- Снег из малопосещаемого места
- Снег из дворовой территории
- Дистиллированная вода
Данный опыт проводился аналогично первому опыту, ход опыта представлен на рисунке 2, а результаты наблюдений в таблице.
Во втором опыте исследовались четыре образца воды (снег с магистрали, снег с малопосещаемого места, снег из дворовой территории и дистиллированная вода). Наблюдения представлены в таблице, откуда видно, что в исследуемых образцах нет кислоты и щелочи. Опыт показал, что снег с магистрали содержит значительное количество хлорид ионов и небольшое количество сульфат ионов. Другие образцы не содержат в обнаруживаемых количествах ни сульфат, ни хлорид ионов.
Если предположить, что изучаемые образцы воды могут содержать хлорид ионы в виде хлорид магния, а сульфат-ионы в составе сульфата натрия, то можно записать следующие уравнения реакций:
Качественная реакция на хлорид-ионы:
2AgNO3 + MgCl2 = 2AgCl + Mg(NO3)2
2Ag+ + 2NO3- + Mg2+ + 2Cl- = 2AgCl + Mg2+ + 2NO3-
Качественные реакции на сульфат-ионы:
Ba 2+ + 2Cl - + 2Na + + SO4 2- = BaSO4 + 2Na + + 2Cl -
Таким образом, используя образцы природной и водопроводной воды, с помощью качественных реакций, я определила содержание ионов хлорида и бария, кислотность воды.
Опыты показали, что водопроводная вода из Красного Села определяемые с помощью качественной реакции, количества хлорид ионов, а водопроводная вода из гимназии - нет.
3. Закрепление знаний учебного материала (10 мин).
На данном этапе учащимся предлагается выполнить практическое задание по проведению качественных реакций.
С помощью качественных реакций доказать, что выданные вам вещества - растворы серной кислоты (пробирка №1), гидроксида калия (пробирка №2) и хлорида бария (пробирка №3). Записать наблюдения и уравнения соответствующих реакций. Учащиеся выполняют задания в парах и заполняют таблицу:
| ФИО | |
| Уравнение диссоциации соли в растворе | |
| Качественная реакция на катион | Необходимый реактив |
Домашнее задание обычно отсутствует.
4. Завершение урока (1-2 мин).
Учитель благодарит учащихся за урок, оценивает деятельность учащихся в целом и отдельных учащихся индивидуально. Собирает таблицы с выполненным заданием.
Задачей аналитической химии является определение состава исследуемого объекта, т. е. распознавание содержащихся в нём элементов и установление их точного количества. Первую часть задачи возможно решить посредством проведения качественных реакций на ионы (неорганических веществ) и функциональные группы (органическая химия).

Основные признаки качественной реакции
Качественная реакция — это химическое взаимодействие определяемого вещества и реагента, сопровождающееся ярким внешним эффектом. Кроме того, реакции должны быть специфичными, т. е. возможными только для определённого элемента или группы соединений. К их эффектам могут относиться:
- выделение газа;
- изменение цвета раствора;
- выпадение или растворение осадка (для теоретического предположения достаточно воспользоваться таблицей растворимости).

Так как в аналитической химии широко применяют физические и физико-химические методы анализа, то для некоторых веществ признаком прохождения качественной реакции становятся изменение окраски пламени горелки при внесении в него вещества, начало люминесценции при ультрафиолетовом облучении или характе?рная форма образующихся кристаллов (которую возможно рассмотреть только при помощи микроскопа).
Аналитические группы

Качественные реакции на катионы и анионы принято классифицировать по так называемым аналитическим группам, приняв за основной признак деления взаимодействие ряда ионов со специальным, групповым реагентом. Продуктами таких реакций будут соединения с похожими свойствами, например, осадки, плохо растворимые в воде, или неустойчивые комплексы.
Самой распространённой схемой деления является сероводородная, где групповыми реагентами являются карбонат аммония, раствор сероводорода и соляная кислота. Свойства образуемых хлоридов, сульфидов и карбонатов позволяют определить 5 аналитических групп, к которым относятся ионы:
- K+, Na+, NH4+, Mg2+;
- Ba2+, Ca2+, Sr2+;
- Al3+, Cr3+, Fe3+, Fe2+, Ni2+, Co2+, Mn2+, Zn2+;
- Cu2+, Cd2+, Bi3+, As3+, Sn2+, Sn4+, Sb3+;
- Ag+, Pb2+, Hg.
Групповые реакции в химии используются не только для определения состава, но и для переведения ионов в инертное (не реакционноспособное) состояние.
Этот приём называется маскированием и своей целью имеет устранение соединений, мешающих проведению определённых химических исследований объекта.
Обнаружение катионов

Изменение окраски пламени является самым эффектным признаком качественной реакции и распространяется на определённое количество катионов неорганических веществ. За счёт выделения избытка энергии пламя становится жёлто-зелёным (Ba2+) и жёлтым (Na+), карминово-красным (Sr2+) и кирпично-красным (Ca2+), и даже фиолетово-розовым (K+). Тем не менее такой способ не является наиболее эффективным, так как интенсивность окраски напрямую зависит от концентрации, а определение цвета является субъективным. Поэтому результаты обычно проверяют дополнительно, используя иные реакции.
| Аналитическая группа | Ион | Реакция | Признак |
| I | K+ | KCl + NaHC4H4O6 (гидротартрат натрия)=KHC4H4O6 +NaCl | Выпадение белого кристаллического осадка, нерастворимого в воде, растворимого в гидроксиде калия и соляной кислоте |
| NH4+ | NH4Cl+NaOH=NH3 + H2O +NaCl | Выделение аммиака | |
| Mg2+ | MgCl2+2Na2CO3+H2O=(MgOH)2CO3+4NaCl+CO2 | Образование белого аморфного осадка | |
| II | Ba2+ | 2BaCl2+K2Cr2O7+H2O=2BaCrO4+2HCl | Жёлтый осадок, растворимый в HCl и нерастворимый в CH3COOH |
| Ca2+ | CaCl2+Na2CO3=CaCO3+2NaCl | Белый кристаллический осадок | |
| III | Zn2+ | ZnCl2+H2S=ZnS+2HCl | Белый осадок |
| Cr3+ | 2CrCl3+3H2O2+10KOH=2K2CrO4+8H20+6KCl | Появление жёлтой окраски | |
| Mn2+ | 2Mn(NO3)2+5PbO2+6HNO3=2HMnO4+5Pb(NO3)2+2H2O | Красно-фиолетовый цвет раствора | |
| Fe2+ | FeSO4+K3Fe(CN)6=KFeFe(CN)6+K2SO4 | Синий осадок | |
| Fe3+ | FeCl3+4KSCN=K Fe(SCN)4+3KCl | Ярко-красный цвет раствора | |
| IV | Cu2+ | CuSO4+4NH3=Cu(NH3)4SO4 | Устойчивый комплекс ярко-синего цвета |
| Cu2+ | CuCl2+H2S=CuS+2HCl | Чёрный, нерастворимый в воде и разбавленных кислотах, осадок |
Пятая группа отличается тем, что катионы серебра, свинца и меди, образуют малорастворимые в воде соединения характе?рной окраски, позволяющие без труда отличить их от других веществ. Например, серебро образует следующие осадки — AgSO4 бесцветный, Ag2S чёрный, AgI жёлтый, AgBr бледно-жёлтый, AgCl белый творожистый и Ag3PO4 жёлтый кристаллический, свинец — PbI2 ярко-жёлтый, PbSO4 белый.
Кроме того, и сам ион серебра является специфическим реагентом, только не для неорганической химии, а для органических соединений.
Определение анионов
По групповому реагенту и органические, и неорганические анионы делятся на три группы: групповой реагент BaCl2, AgNO3 (или HNO3) или групповой реагент отсутствует. Для I группы (SO4(2-), PO4(3-), SO3(2-)) признаком прошедшей качественной реакции является образование бесцветных и малорастворимых соединений. Нитрат серебра образует с анионами II группы (ионы галогенов) характерно окрашенные соединения, растворимые в азотной кислоте.
Для определения остальных анионов существуют специфические реакции, например, NO3- взаимодействует с дифениламином ((С6H5)2NH), окрашивая раствор в очень яркий оттенок фиолетового.
Эта реакция проводится капельным методом, т. е. с помощью микропипеток на стеклянные пластинки наносится по 1-2 капли обоих реагентов, что является достаточным для получения яркого внешнего эффекта.
Качественные реакции имеют большое значение для химии. При помощи относительно простых специфических реакций становится возможным установить, какие же вещества находятся в смеси, и в дальнейшем провести ряд сложных операций, направленных на её разделение, экстракцию определённых соединений и т. д. Это используют и в исследовательских, и в промышленных лабораториях, следящих за контролем качества продукции.
Теория по заданию 25. Качественные реакции в неорганической химии
Рассмотрим некоторые наиболее часто встречающиеся случаи:
1. Среда раствора
1) Изменение окраски индикаторов:
Фенолфталеин (бесцветный) применяется для определения щелочной среды реакции. Изменяет цвет на малиновый.
Лакмус (фиолетовый) в кислой среде становится красным, в щелочной - синим.
2) Среда раствора аммиака NH3 является щелочной, так как протекает обратимое взаимодействие с водой: NH3 + H2O NH4 + + OH – .
В случае аминов среда также является щелочной. Анилин с водой не реагирует и не изменяет окраску индикаторов (т.е. среда остается нейтральной).
3) H2SiO3 является очень слабой нерастворимой в воде кислотой, поэтому она не изменяет окраску индикаторов.
2. Как отличить металлы различной активности

Например, щелочные и щелочноземельные металлы можно отличить от других металлов реакцией с водой. Первые реагируют быстро и очень бурно в обычных условиях:
Ca + 2H2O -> Ca(OH)2 + H2 (в обычных условиях)
3Fe + 4H2O -> без нагревания реакция не идет.
3. Как отличить оксиды щелочных и щелочноземельных металлов от оксидов других металлов
Оксиды Ш и ЩЗ металлов реагируют с водой в обычных условиях:
Na2O + H2O -> 2NaOH
ZnO + H2O -> реакция не идет
4. Как отличить кислоты-окислители от кислот-неокислителей
В отличие от обычных кислот кислоты-окислители реагируют с металлами, стоящими в ряду напряжений правее водорода:

HCl + Cu -> реакция не идет
4HNO3(к) + Cu -> Cu(NO3)2 + 2NO2 + 2H2O (выделение бурого газа)
5. Как отличить соли слабой и сильной кислот
В этом случае часто берут соль угольной или кремниевой кислот. В реакциях этих солей с сильными кислотами выделяется газ или выпадает осадок:
Na2CO3 + 2HCl -> 2NaCl + CO2 + H2O
Na2S + 2HCl -> 2NaCl + H2S
Na2SiO3 + 2HCl -> 2NaCl + H2SiO3
Na2SO4 + HCl -> реакция не идет (осадок, газ, малодиссоциирующее вещество не образуются).

BaSO3 + 2HCl -> BaCl2 + SO2 + H2O
BaSO4 + HCl -> реакция не идет (газ или более слабая кислота не образуются)
6. Как отличить соли слабого и сильного основания
Zn(NO3)3 + 3NaOH -> Zn(OH)2 + 3NaNO3
NH4NO3 + NaOH -> NH3 + NaNO3 + H2O
KNO3 + KOH -> реакция не идет (газ или более слабая кислота не образуются)
7. Как отличить соли двух металлов, один из которых образует амфотерные соединения (например, Zn, Be, Al и др.)
Часто реагентом, которым можно отличить эти типы солей, является щелочь

Al(NO3)3 + 4KOH(р) -> 3KNO3 + K[Al(OH)4] - осадок Al(OH)3 растворяется в избытке щелочи
Ca(NO3)2 + 2KOH -> Ca(OH)2 + 2KNO3 - осадок не растворяется.
8. Как отличить гидроксиды двух металлов, один из которых образует амфотерные соединения (например, Zn, Be, Al и др.)
Этим реагентом является щелочь
Zn(OH)2 + 2NaOH -> Na2[Zn(OH)4] (растворение осадка)
Mg(OH)2 + NaOH -> реакция не идет.
9. Как отличить соли двух металлов, один из которых образует малорастворимые или нерастворимые гидроксиды:
Часто реагентом, которым можно отличить эти типы солей, является щелочь

KNO3 + KOH -> реакция не идет (газ или более слабая кислота не образуются)
Ca(NO3)2 + 2KOH -> Ca(OH)2 + 2KNO3
10. Как отличить соль и кислоту
1) с металлом (выделение водорода в реакциях с кислотами-неокислителями)

KCl + Fe -> реакция не идет
2HCl + Fe -> FeCl2 + H2
2) с кислыми карбонатами или сульфитами (выделение газа)

HCl + NaHCO3 -> NaCl + CO2 + H2O
KCl + NaHCO3 -> реакция не идет (осадок, газ, малодиссоциирующее вещество не образуются).
11. Как отличить кислую соль от средней
Кислые соли слабых кислот, например гидрокарбонаты, реагируют с сильными кислотами с выделением газа:

NaHCO3 + HCl -> NaCl + CO2 + H2O
NaNO3+ HCl -> реакция не идет (осадок, газ, малодиссоциирующее вещество не образуются).
12. Как отличить кислоту от воды
1) Индикатором, например, лакмус в кислой среде становится красным.

2) Если кислота сильная, то можно добавить соль слабой кислоты (например, Na2CO3, NaHCO3), чтобы выделился газ:
2HNO3 + Na2CO3 -> 2NaNO3 + CO2 + H2O
H2O + Na2CO3 -> растворение соли, видимых признаков нет.
13. Как отличить растворимую соль от щелочи

Провести реакцию ионного обмена с образованием осадка или газа, например:
2KOH + CuCl2 -> Cu(OH)2 + 2KCl
NaCl + CuCl2 -> реакция не идет, так как ни газ, ни осадок, ни малодиссоциирующее соединение не образуется.
14. Как распознать присутствие фосфатов
Растворимые фосфаты можно отличить от других солей в реакции с растворимой солью алюминия или лития, так как в результате выпадает белые осадки AlPO4 или Li3PO4. Также можно использовать растворимые соли бария или серебра, так как в этих случаях также образуются осадки: Ba3(PO4)2 белого цвета и Ag3PO4 - желтого цвета.
AlCl3 + Na3PO4 -> AlPO4 + 3NaCl
3LiCl + Na3PO4 -> Li3PO4 + 3NaCl
KCl + Na3PO4 -> реакция не идет(осадок, газ, малодиссоциирующее вещество не образуются).
15. Как распознать присутствие сульфатов
Сульфаты можно отличить от других солей в реакции с растворимой солью бария, так как в результате выпадает белый осадок BaSO4:

MgSO4 + Ba(NO3)2 -> BaSO4 + Mg(NO3)2
MgCl2 + Ba(NO3)2 -> реакция не идет(осадок, газ, малодиссоциирующее вещество не образуются).
16. Как распознать присутствие солей аммония

(NH4)2SO4 + 2NaOH -> Na2SO4 + 2NH3 + 2H2O
Na2SO4 + NaOH -> реакция не идет(осадок, газ, малодиссоциирующее вещество не образуются).
17. Как распознать присутствие галогенид-ионов
в реакции с растворимой солью серебра
AgNO3 + NaCl -> NaNO3 + AgCl (осадок белого цвета)
AgNO3 + NaBr -> NaNO3 + AgBr (осадок желтого цвета)
AgNO3 + NaI -> NaNO3 + AgI (осадок ярко-желтого цвета)
18. Как распознать присутствие катионов серебра Ag +

1) в реакции растворимой соли серебра с щелочью
2AgNO3 + 2KOH -> 2KNO3 + Ag2O + H2O (в осадок выпадает черный Ag2O)
2) в реакции растворимой соли с галогенидами (также растворимыми)
AgNO3 + NaCl -> NaNO3 + AgCl (осадок белого цвета)
AgNO3 + NaBr -> NaNO3 + AgBr (осадок желтого цвета)
AgNO3 + NaI -> NaNO3 + AgI (осадок ярко-желтого цвета)
19. Как распознать присутствие катионов лития Li +

3LiOH + Na3PO4 -> Li3PO4 + 3NaOH (в осадок выпадает белый Li3PO4)
20. Как распознать присутствие аммиака NH3
Аммиак образует с ионами Cu 2+ комплексные анионы фиолетового цвета: CuCl2 + 4NH3 -> [Cu(NH3)4]Cl2.
21. Галогены
I2 - кристаллы чёрно-серого цвета с фиолетовым металлическим блеском, легко образует фиолетовые пары. Образование I2 в растворе дает характерную коричневую окраску.
Качественные реакции в органической химии используются для быстрого распознавания класса соединения. Для таких реакций характерно проявление внешних эффектов — изменение цвета раствора, выпадение осадка или выделение газа.
Качественные реакции на алканы
- При горении алканов пламя становится голубым.
- Реакция окисления алканов перманганатом калия на холоде не идет – раствор не меняет цвет.
Качественные реакции на алкены

- Реакция Вагнера – обесцвечивание раствора перманганата калия, сопровождается выпадением темно-коричневого осадка диоксида марганца:
- Обесцвечивание бромной воды:

Качественные реакции на алкины
- Реакция Вагнера – раствор перманганата калия обесцвечивается и выпадает осадок черного цвета (диоксид магния):
- Обесцвечивание бромной воды:
- С реактивом Толленса (гидроксид диамин серебра) только алкины с крайними тройными связями образуют осадок ацетиленида серебра. Алкины с другим расположением тройной связи в реакцию не вступают:

Качественные реакции на альдегиды
- Реакция серебряного зеркала с реактивом Толленса при нагревании — серебро покрывает зеркальным слоем стенки пробирки. При некачественном проведении эксперимента выпадает черный осадок мелкодисперсного серебра:
- Со свежеприготовленным гидроксидом меди при нагревании альдегиды образуют красно-оранжевый осадок оксида меди (I):
- С реактивом Несслера (щелочной раствор тетраиодомеркурата (II) калия) образуется осадок металлической ртути черного цвета:
- При взаимодействии бесцветных альдегидов с раствором бесцветной фуксинсернистой кислоты раствор окрашивается в светло-фиолетовый цвет.
Качественные реакции на спирты
Спирты делят на одно- и многоатомные (по количеству ОН-групп) и определяют с помощью разных качественных реакций.
1. Для одноатомных спиртов
1.1 С оксидом меди (II) — над раскаленным оксидом пропускают пары спирта, образуется альдегид, который выявляют пробой с фуксинсернистой кислотой – раствор окрашивается в характерный бледно-фиолетовый цвет:

1.2 Йодоформная проба – с йодом и гидроксидом натрия образуется йодоформ, осадок желтого цвета:

1.3. Проба Лукаса для выявления вторичных и третичных спиртов – первичные в реакцию не вступают. При взаимодействии одноатомных спиртов с концентрированным раствором соляной кислоты и хлорида цинка раствор расслаивается и образуется мутный маслянистый слой алкилхлорида:

2. Для многоатомных спиртов на примере глицерина
Голубой осадок гидроксида меди (II) при нормальных условиях растворяется в глицерине с образованием комплексного соединения меди ярко-синего цвета:

Качественные реакции на карбоновые кислоты
1. Фиолетовый раствор лакмуса карбоновые кислоты окрашивают в красный цвет.
2. Разложение под действием серной кислоты на угарный газ и воду. Выделяющийся угарный газ можно поджечь – он горит синим пламенем.
Для муравьиной кислоты:

Аналогично разлагается и многоосновная щавелевая кислота:

3. Реакция щавелевой кислоты с солями меди (II) – выпадает зелено-голубой кристаллический осадок оксалата меди:

Качественные реакции на амины
- Фиолетовый раствор лакмуса амины окрашивают в синий цвет.
- Образование дыма в результате взаимодействия летучих аминов с газообразным хлороводородом.
- Первичные амины с хлороформом в щелочной среде образуют соединения – изонитрилы с характерным неприятным запахом:

Качественные реакции на анилин
- При действии хлорной извести водный раствор анилина приобретает интенсивный фиолетовый цвет.
- При бромировании образуется белый осадок 2,4,6-триброманилина:

Качественные реакции на фенол
- При взаимодействии с хлоридом железа (III) раствор приобретает фиолетовый цвет:
- С бромной водой образует твердый белый осадок 2,4,6-трибромфенола:
- При поликонденсации фенолов с альдегидами в кислой или щелочной среде образуются смолообразные полимеры и вода.
Качественные реакции на алкилхлориды
Проба Бейльштейна – качественная реакция определения хлора в органических соединениях.
Образец алкилхлорида на прокаленной медной проволоке помещают в пламя горелки, которое становится сине-зеленым.
Качественные реакции на углеводы
Углевод содержат альдегидные и гидрокси- группы — характерными будут реакции на спирты и альдегиды.
1. Крахмалсодержащие растворы под действием йода становятся синими.
- при нагревании раствор обесцвечивается;
- охлажденный – восстанавливает синий цвет.
2. Проба Селиванова определяет наличие фруктозы. В присутствии резорцина и соляной кислоты углевод приобретает красно-вишневый цвет.

Читайте также:
 webdonsk.ru
webdonsk.ru