Как сделать из хлорида железа гидроксид железа
Добавил пользователь Владимир З. Обновлено: 10.09.2024
В данной статье разберем ОВР, связанные с железом и его соединениями.
Железо – металл средней активности. В реакциях – восстановитель.
Более сильные окислители переводят железо в степень окисления +3 (например, галогены (кроме I2), азотная кислота, серная концентрированная кислота).
При взаимодействии железа с нитратами, хлоратами или пероксидами в щелочной среде образуются ферраты.
Оксид железа (II) FeO
Основный оксид, легко окисляется (проявляет восстановительные свойства).
Может проявлять свойства слабого окислителя.
Оксид железа (III) Fe2O3
Амфотерный оксид с преобладанием основных свойств. Может проявлять как окислительные, так и восстановительные свойства.
Восстановительные свойства
Окислительные свойства
Двойной оксид Fe3O4 (FeO*Fe2O3)
Гидроксид железа (II) Fe(OH)2
Слабое основание, проявляет восстановительные свойства.
Гидроксид железа (III) Fe(OH)3
Амфотерный гидроксид с преобладанием основных свойств (более слабое основание, чем Fe(OH)2). Проявляет восстановительные свойства. Сильными окислителями может окисляться до ферратов, соединений железа (VI):
Получение Получают растворением железа в соляной кислоте (в частности, при травлении стальных изделий).
Как можно получить гидроксид железа 2 из железа?
Получим гидроксид железа (II) Fe(OH)2. Для этого воспользуемся реакцией растворимой соли железа (II) со щелочью: соединим сульфат железа (II) и гидроксид калия.
Как из хлорида железа сделать гидроксид железа?
Получим гидроксид железа (III) Fe(OH)3 взаимодействием растворов хлорида железа (III) FeCl3 и гидроксида калия KOH. Это обычный способ получения нерастворимых оснований – реакция обмена растворимой соли и щелочи. Выпадает бурый осадок. Это гидроксид железа (III).
Какие гидроксиды образуют железо?
Гидроксид железа(III)
| Гидроксид железа(III) | |
|---|---|
| Традиционные названия | Гидроокись железа |
| Хим. формула | Fe(OH)3 |
| Физические свойства | |
| Состояние | красновато-коричневые кристаллы |
Как можно получить сульфат железа 2?
Получение Железный купорос можно приготовить действием разбавленной серной кислоты на железный лом, обрезки кровельного железа и т. д. В промышленности его получают как побочный продукт при травлении железных листов, проволоки, удалении окалины и др.
Что показывает Формула fecl3?
Хлорид железа(III) (хлорное железо, также - трихлорид железа) FeCl3 — средняя соль трёхвалентного железа и соляной кислоты, слабое амфотерное соединение. .
Какие свойства проявляет гидроксид железа 2?
Чистый гидроксид железа(II) — кристаллическое вещество белого цветана фото - коричневый цвет. Иногда имеет зеленоватый оттенок из-за примесей гидроксида железа(III). Со временем на воздухе темнеет вследствие окисления. Нерастворим в воде (растворимость 5,8?10-6 моль/л).
Как образуется гидроксид железа 2?
Получается при взаимодействии солей железа (II) с раствором щелочи в отсутствии кислорода воздуха: FeSO4 + 2NaOH = Fe(OH)2 + Na2SO4. Соли железа (II). Железо (II) образует соли практически со всеми анионами.
Как из сульфата железа получить гидроксид?
- Взаимодействие сильноосновного оксида с водой позволяет получить сильное основание или щёлочь. .
- Гидроксиды малоактивных металлов получают при добавлении щелочи к растворам соответствующих солей. .
- Также основание можно получить при взаимодействии щелочного или щелочноземельного металла с водой.
Как отличить железо 2 от железа 3?
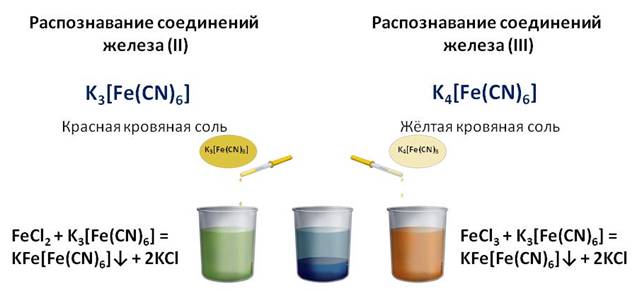
Качественная реакция на ион железа (II) – реакция с красной кровяной солью. Добавим красную кровяную соль - гексацианоферрат калия K3[Fe(CN)6]. (Для определения железа (III) используют желтую кровяную соль K4[Fe(CN)6]). В присутствии ионов железа (II) образуется темно-синий осадок.
Как получить оксиды железа?
Получают косвенным путём при восстановлении Fe 2О 3 или при разложении оксалата FeC 2O 4·2Н 2О в атмосфере азота. ); g-Fe 2О 3 (минерал оксимагнетит) получают окислением железа или Fe 3О 4 при темп-ре ниже 200 °С; d-Fe 2О 3 образуется при окислении солей железа(II) в щелочной среде.
Какие свойства проявляют оксиды и гидроксиды железа 3?
Гидроксид железа (III) Fe(OH)3 – кристаллическое или аморфное вещество бурого цвета. Как и оксид, проявляет слабовыраженные амфотерные свойства с преобладанием основных. Легко реагирует с кислотами: Fe(OH)3 + 3HCl = FeCl3 + 3H2O.
Какое вещество является основанием?
Это гидроксиды щелочных и щелочноземельных металлов (и магния), а также металлов в минимальной степени окисления (если она имеет переменное значение). Например: NaOH, LiOH, Mg(OH)2, Ca(OH)2, Cr(OH)2, Mn(OH)2.
Какие свойства проявляют атомы железа?
Простое вещество железо — ковкий металл серебристо-белого цвета с высокой химической реакционной способностью: железо быстро корродирует при высоких температурах или при высокой влажности на воздухе. В чистом кислороде железо горит, а в мелкодисперсном состоянии самовозгорается и на воздухе.


Часовой пояс: UTC + 3 часа
Хлорное железо
Здравствуйте, простите заранее за глупый вопрос, но как правильно разводить безводное хлорное железо? То что 3 к 1 по объёму это я знаю, просто никак не могу правильно сделать раствор
К примеру на 1 литр воды сколько грамм безхлорного хлорного железа. Заранее всех благодарю
Привет Vasilisk. FeCl надо раствориь столько, чтобы цвет раствора был как крепкий чай. Желательно использовать десцилированную воду. Удачи и привет коту!
JLCPCB, всего $2 за прототип печатной платы! Цвет - любой!
Сборка печатных плат от $30 + БЕСПЛАТНАЯ доставка по всему миру + трафарет
На мой взгляд лучше разводить 1 к 2, т.е. 100 грамм хлорного железа разводите 200 граммами воды, желательно теплой.
Приглашаем 27/01/2022 всех желающих посетить вебинар, посвященный двум наиболее растущим сегментам интегрированных источников питания – AC/DC малой мощности (1-20Вт) и сегменту решений PoL без изоляции. На вебинаре рассмотрим проблему выбора AC/DC в бюджетном сегменте и концепцию тестирования ускоренного старения, проведем сравнительный анализ подходов к интеграции AC/DC модулей. Сделаем обзор решений концепции POL с доисторических времен до современных технологий и средств для разработки и тестирования.
Для начинающих и не только могу посоветовать книжку Николаенко Н.М. "Секреты радиолюбителя-конструктора". В ней многое что есть.
_________________
Если хотите, чтобы жизнь улыбалась вам, подарите ей своё хорошее настроение
Компания Mornsun выпустила три серии источников питания с креплением на DIN-рейку в форм-факторе Home Automation на популярные значения выходной мощности 30, 60 и 100 Вт (серии LI30-20/PR2, LI60-20/PR2, LI100-20/PR2). Эти источники питания относятся ко второму поколению продукции (R2) и характеризуются высокой надежностью и хорошей стоимостью.
Разводить можно как угодно, от этого будет зависеть скорость травления. Я делаю концентрацию гораздо меньше обычных 1:2 - 1:3. Травит дольше, но по окончании раствор полностью вырабатывается, и можно сразу выливать, не хранить.
_________________
Если долго мучиться, что-нибудь. сломается.
У меня на "фирменной" 250г. банке написано развести в 1-1.5 л. воды.
Сыпать можно да-же в ледяную воду, но только по немного, т.к. при реакции все это дело не хило греется, так что осторожнее, что-бы не закипело, пластик не расплавился, а стекло не треснуло (это я про посуду).
А вот травить потом действительно лучше в слегка подогретом растворе.
Новый раствор травит буквально за 3-5 минут, последующие травления занимают немного больше времени.
Хранить раствор удобно в герметичной бутылке из под спрайта или кока-колы (только этикетку снимите, что-бы ктонить не выпил.)

Всем огромное спасибо
Сегодня попробую концентрацию на 200 гр. воды добавлю 100 грамм хлорного железа
я обчно развожу в гаряченькой водичке на глаз тоесть до цвета хорошо завареного чая, но есть еще и разное(!) хлорное железо, то что продаеться порошочком черным проверено га***, а то что мокроватое и коричневое кайф.
_________________
нет нет а вот и даааааааааааа.
упс. рвануло.
зря я это сделал.
Мне наоборот показалось что 6 водное железо полное га***, а вот безводное (чёрный порошок) самое то, развёл в пропорции 1к 3 и никаких проблем нет, травилось за 10 минут
Когда разводишь безводное ХЖ - всыпай потихоньку ХЖ в воду, а не вливай воду в ХЖ. Когда я первый раз его по привычке залил кипяткум е***ло нехило и вся кухня была загажена!
А я не выливаю расствор после травления, я его восстанавливаю железными гвоздями, фильтрую и убираю до следующего раза. .
_________________
нет нет а вот и даааааааааааа.
упс. рвануло.
зря я это сделал.
А я не выливаю расствор после травления, я его восстанавливаю железными гвоздями, фильтрую и убираю до следующего раза. .
Всё ок, только ионов хлора от этого больше не становиться - раствор подкислять надо соляной кислотой - а пойди, найди её. И по деньгам получается, что дешевле новый раствор приготовить, чем старый восстанавливать.
_________________
Друзья мои. Режте карточки вдоль магнитной полосы!
Я лично развожу литр крепкого раствора, а потом пользуюсь им полгода. Первое время травится по 15-20 мин, потом по 40 мин.

С помощью данного видеосюжета учащиеся узнают об особенностях строения атома железа, о физических и химических свойствах железа, о нахождении в природе и его получении. Все уравнения химических реакций рассматриваются с позиции процессов окисления-восстановления. Видеосюжет содержит опыты по получению гидроксидов железа (II) и (III) и исследованию их свойств. Для большей наглядности приведены рисунки, иллюстрирующие качественные реакции на ионы железа (II) и (III).
В данный момент вы не можете посмотреть или раздать видеоурок ученикам
Чтобы получить доступ к этому и другим видеоурокам комплекта, вам нужно добавить его в личный кабинет, приобретя в каталоге.
Получите невероятные возможности



Конспект урока "Железо, его соединения"
Железо, его соединения
Сначала рассмотрим особенностей строение атома железа.
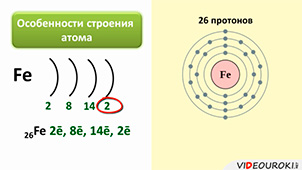
Железо является элементом побочной подгруппы VIII A группы. Поэтому его электронное строение отличается от строения электронных оболочек элементов главных подгрупп. Так как железо расположено в 4 периоде, то атомы его имеют четыре энэргетических уровня, к тому же заполняется у него сначала не внешний, а предвнешний энэргетический уровень. В ядре атома железа содержится 26 протонов. На внешнем энэргетическом уровне у атома железа находится два электрона, а на предвнешнем – 14.
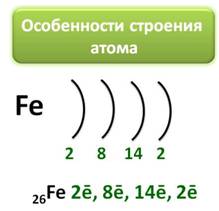
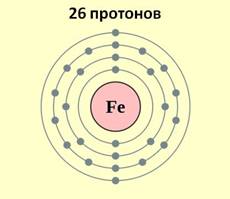
Железо имеет на внешнем энэргетическом уровне два электрона, является металлом, поэтому как и все металлы он отдаёт электроны и проявляет восстановительные свойства. Если атом железа отдаёт два внешних электрона, тогда он приобретает степень окисления +2, к тому же электрон с предвнешнего уровня тоже может оторваться, тогда степень окисления становится +3.

Рассмотрим железо, как простое вещество.
· блестящий серебристо-белый металл
· имеет темературу плавления 1539 0 С
· плотность железа 7,87 г/см 3
· железо пластичное и ковкое, поэтому легко обрабатывается
· обладает способностью намагничиваться и размагничиваться.
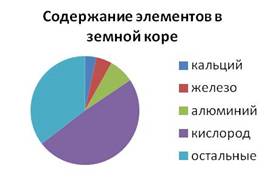
По распространённости в земной коре железо занимает четвёртое место и второе среди металлов (после алюминия). Его массовая доля в земной коре составляет четыре целых шестьдесят пять сотых процента.
Железо образует ряд минералов:
· магнитный железняк, или магнетит Fe3O4
· красный железняк, или гематит Fe2O3
· бурый железняк, или лимонит 2 Fe2O3 ? 3 H2O
· большое значение имеет и железный колчедан, или пирит FeS2 который используют при произвостве серной кислоты
· в природных и некоторых минеральных водах встречается гидрокарбонат железа – Fe(HCO3)2
Вообще, различают технически чистое и химически чистое железо. Технически чистое железо представляет собой низкоуглеродистую сталь, содержащую 0,02 – 0,04 % углерода, а также небольшое содержание кислорода, серы, азота и фосфора. Химически чисто железо содержит 0,01 % примесей.
Из технически чистого железа сделаны канцелярские скрепки, кнопки, но оно легко корродирует.


Химически чистое железо, напротив, почти не корродирует. Вот почему железная колонна в Дэли, построенная ещё в пятнадцатом веке не ржавеет, потому что она сделана из чистого железа.




Алхимики обозначали железо в виде копья и щита, которые символизировали бога войны Марса.


Для современного человека железо играет огромную роль, ведь имеено оно составляет основу техники и машиностроения. Железо как никакой другой металл способен изменять свои технические характеристики в результате легирования и специальной обработки. В настоящее время известно очень много сплавов этого металла, отличающихся разнообразием свойств:
· устойчивые в морской воде
· выдерживающие действие высоких температур и агрессивных сред
· мягкие для производства проволоки
· жёсткие для производства пружин
· магнитные и немагнитные.
Широко используются чугун и сталь. Оксид железа (III) используется как пигмент в производстве красок (охра).
Железо можно получить восстановлением из железных руд углеродом (коксом), оксидом углерода два, водородом, алюминием, то есть пирометаллургическим способом.

Изучая химические свойства железа, следует учитывать, что оно может иметь степень окисления +2 и +3. Это всё зависит от окислительной способности тех веществ, с которыми реагирует железо.
Железо реагирует с простыми и сложными веществами. Однако оно малоактивно при обычных условиях.
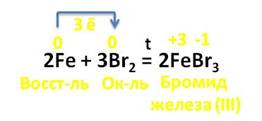
Например, в реакции с галогенами (кроме йода) железо образует галогениды, в которых его степень окисления его +3. В реакции с бромом каждый атом железа отдаёт по 3 электрона молекуле брома. При этом образуется бромид железа (III), где степень окисления железа +3, а брома – -1. В этой реакции железо выступает в роли восстановителя, а бром – в роли окислителя.
В реакции с серой железо образует сульфид железа (II), в котором степень окисления железа +2, а серы – -2. В данной реакции каждый атом железа отдаёт по 2 электрона молекуле серы. Причём, железо является восстановителем, а сера – окислителем.

А вот в реакции железа с кислородом, образуется железная окалина, состоящая из оксидов железа (II) и (III). В этой реакции 3 атома железа отдаёт 8 электронов молекуле кислорода, выступая в роли восстановителя, а кислород – в роли окислителя.
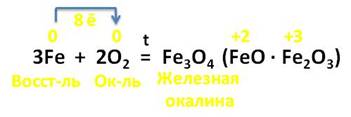
Железо реагирует и со сложными веществами.
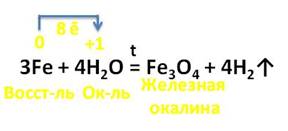
Например, с парами воды железо реагирует при нагревании, при этом образуется опять железная окалина и выделяется водород. Здесь также три атома железа отдают 8 электронов ионам водорода, железо является восстановителем, а ионы водорода – окислителем.
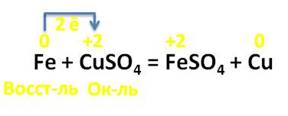
Железо взаимодействует с растворами солей, оно вытесняет металлы, которые стоят правее его в электрохимическом ряду напряжений металлов. Например, в реакции с раствором сульфата меди (II), железо вытесняет медь. В этой реакции железо повышает свою степень окисления с 0 до +2, а медь, наоборот, понижает свою степень окисления с +2 до 0. Каждый атом железа отдаёт по 2 электрона ионам меди. Железо выступает в роли восстановителя, а медь – в роли окислителя.
С растворами кислот железо также реагирует. Например, в реакции с разбавленной соляной кислотой железо окисляется до соли железа со степенью окисления железа +2. Эту реакцию можно наблюдать наглядно: для этого следует налить в пробирку раствора соляной кислоты и поместить туда кусочек железа, при этом можно наблюдать выделение пузырьков газа. Это выделяется водород. Причём ещё образуется и соль – хлорид железа (II).
В уравнении реакции каждый атом железа отдаёт по два электрона ионам водорода. Железо изменяет свою степень окисления с 0 до +2, при этом является восстановителем, а водород понижает свою степень окисления с +1 до 0 и ионы водорода являются окислителем.

А концентрированная серная и азотная кислоты не реагируют с железом, потому что они пассивируют его, образуя на поверхности металла прочную оксидную плёнку.

У железа со степенью окисления +2 есть ряд соединений. Например, FeO – оксид железа (II) и гидроксид желза два. Прямой реакцией получить гидроксид железа два из оксида железа два невозможно, нужно сначала получить соль железа, а только потом гидроксид.
Осуществим следующие превращения: получим хлорид железа (II) из железа, затем из хлорида железа (II) получим гидроксид железа (II), а потом и оксид железа (II).
Для того, чтобы получить хлорид железа (II) в первой стадии, необходимо, чтобы железо прореагировало с разбавленной соляной кислотой, затем к хлориду железа (II) следует добавить щёлочь, например, гидроксид натрия. Таким образом, мы получим гидроксид железа (II), а прокаливая нерастворимое в воде основание гидроксид железа (II) мы сможем получить и оксид железа (II).
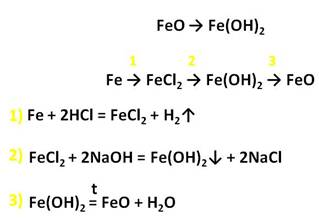
Оксид и гидроксид железа (II) обладает ярко выраженными основными свойствами и реагируют с кислотами. В резульате данных реакций образуются соли железа, в которых степень окисления железа +2.

Оксид железа (II) представляет собой порошок чёрного цвета. Его получают восстановлением оксида железа (III) оксидом углерода (II).

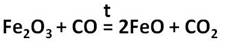
Ионы железа легко окисляются кислородом воздуха или другими окислителями до иона железа +3. Из-за этого окисления зелёный осадок гидроксида железа (II) превращается в гидроксид железа (III) бурого цвета.
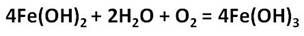
Железо образует и соединения со степенью окисления +3. Это оксид и гидроксид железа (III) , которые получают также косвенным путём. Например, осуществим превращения: получим хлорид железа (III) из железа, затем из хлорида железа (III) следует получить гидроксид железа (III) , а потом оксид железа (III) .
Для получения хлорида железа (III) , нужно, чтобы в реакцию вступило железо с хлором, затем к хлориду железа (III) добавим щёлочь – гидроксид калия и получим гидроксид железа (III) , при нагревании этот гидроксид образует оксид железа (III) и воду.
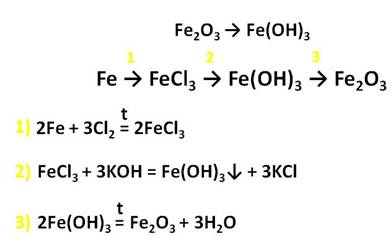
Оксид железа (III) – Fe2O3 – порошок бурого цвета, его получают разложением гидроксида железа (III).

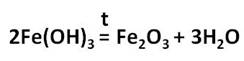
Оксид и гидроксид железа (III) проявляют слабовыраженные амфотэрные свойства и легко реагируют с кислотами, в результате чего образуются соли железа, в которых его степень окисления +3.
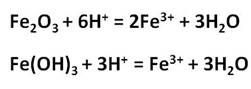
Реакции с концентрированными растворами щелочей протекают лишь при длительном нагревании с образованием ферритов: в результате взаимодействия оксида железа (III) с гидроксидом натрия, образуется феррит натрия, в результате взаимодействия гидроксида железа (III) с гидроксидом натрия, образуется также феррит натрия.
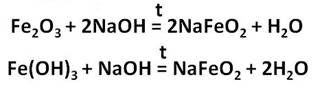
Получим гидроксиды железа (II) и (III) и исследуем их свойства. Для этого, нальём в две пробирки соль железа – хлорида железа (II) и хлорида железа (III). А затем добавим в каждую из них раствора щёлочи, после чего мы можем наблюдать выпадение осадков: в первой пробирке осадок белого цвета, который становится сразу зелёного цвета, а во второй – осадок бурого цвета. Однако со временем, осадок в первой пробирке начинает приобретать бурую окраску за счёт окислительных процессов. Если добавить к этим двум осадкам раствора серной кислоты, то осадок растворяется и в первой и во второй пробирке.
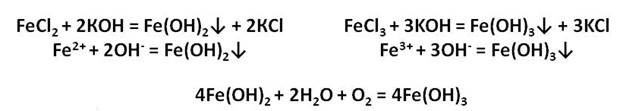
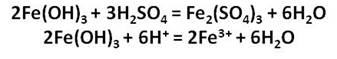
Соли железа имеют большое значение. Так кристаллогидрат сульфата железа (II) FeSO4 ? 7H2O, или железный купорос используется для борьбы с вредителями растений и при приготовлении минеральных красок, а также для обработки древесины.



Для распознавания соединений железа (II) и (III) проводят качественные реакции на эти ионы. Так, качественной реакцией на ион железа (II) служит реакция с красной кровяной солью, а реактивом на ион железа (III) является жёлтая кровяная соль. Если к соединениям железа (II) и (III) добавить соответственно красной и жёлтой кровяной соли, то в обоих случаях образуется синий осадок.
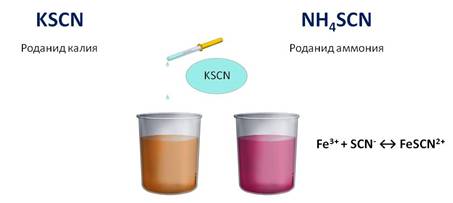
Для обнаружения ионов железа (III) можно использовать и роданид калия или аммония. При этом образуется раствор кроваво-красного цвета.
Роль железа в жизнедеятельности очень велика. Массовая доля железа в животных организмах составляет около одной сотой процента. В организме человека содержится около пяти г железа, главным образом в составе гемоглобина, фермента каталазы. Соединения железа применяют при лечении малокровия, истощении, упадке сил. Суточная потребность человека в железе составляет около пятнадцать тысячных грамма. Железо содержится в шпинате, салате, капусте, чёрной смородине, мясе, сливовом соке, кураге, изюме, семечках тыквы и подсолнуха, чёрном хлебе и других продуктах.
3734 дн. с момента
как существует сайт


Владельцы сайта
Соединения железа II
Физические свойства FeO(II): кристаллы черного цвета; плотность 5,7 г/см 3 ; нерастворим в воде.
Химические свойства FeO(II): это основной оксид;
легко вступает в реакции с кислотами, образуя соли железа:
FeO+H 2 SO 4 = FeSO 4 +H 2 O;
FeO+2HCl = FeCl 2 +H 2 O
4FeO+O 2 = 2Fe 2 O 3
FeO(II) получают восстановлением FeO(III) при высоких температурах:
Fe 2 O 3 +H 2 = 2Fe+H 2 O;
Fe 2 O 3 +CO = 2FeO+CO 2 ?
Физические свойства Fe(OH)2: белый порошок; на воздухе частично окисляется, приобретая зеленый оттенок; не растворяется в воде.
Получение гидроксида железа ?(II)? и изучение его свойств
Получение гидроксида железа ?(II)? и изучение его свойств.mp4
Химические свойства Fe(OH)2:
Fe(OH) 2 проявляет основные свойства;
в присутствии влаги окисляется, образуя гидроксид железа (III), приобретая при этом бурый цвет:
4Fe(OH) 2 +O 2 +2H 2 O = 4Fe(OH) 3
легко реагирует с кислотами:
Fe(OH) 2 +2HCl = FeCl 2 +2H 2 O
Fe(OH) 2 +H 2 SO 4 = FeSO 4 +2H 2 O
в концентрированных растворах щелочей образует ферраты (комплексные соли железа) при кипячении:
Fe(OH) 2 +2NaOH = Na 2 [Fe(OH) 4 ]
разлагается при нагревании:
Fe(OH) 2 = FeO+H 2 O
Поскольку, Fe +2 легко окисляется до Fe +3 , все соединения железа(II) являются восстановителями. Также восстановительными свойствами обладают и соли железа (II).
1. Качественная реакция на ион железа ( II ) – реакция с красной кровяной солью.
о присутствии катионов железа судят по образовавшемуся осадку темно-синего цвета ( турнбулева синь ):
2. Качественная реакция на ион железа ( II ) – реакция со щелочью.
Реакция со щелочью – еще один способ обнаружения ионов железа ( II ). Гидроксид железа ( II ) Fe ( OH ) 2 - серо-зеленого цвета, гидроксид железа ( III ) Fe ( OH ) 3 - бурый.
железо 2+.wmv
Cоли железа
Соли, в которых железо имеет степень окисления +2 (FeCl 2 , FeSO 4 ), обладают восстановительными свойствами:
сульфат железа FeSO4 применяют в качестве фунгицидов, консерванта древесины, как компонент электролитов; хлорид железа FeCl2 применяют для получения хлорида железа (III), в качестве катализатора в органическом синтезе.

Читайте также:
 webdonsk.ru
webdonsk.ru